
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
分析 (1)根据可逆反应没有完全进行,即释放的热量小于完全反应释放的热量分析;
(2)两个反应为等效平衡,达到平衡时各组分的物质的量浓度相等;相同条件下,2molC3达到平衡状态时,与加入2mol A2和1mol B2达建立完全相同的平衡状态,即从化学平衡状态到完全反应生成2molC3,放出热量为c kJ,据此判断;
(3)为使该反应的反应速率增大,且平衡向正反应方向移动,依据影响化学反应速率和化学平衡的因素分析判断;
(4)恒温恒容下,正反应为气体物质的量减小的反应,平衡时压强减小,若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,等效为在原平衡的基础上增大压强,反应物转化率增大;
(5)保持同一反应温度,在相同容器中,将起始物质改为4mol A2、2mol B2,等效为在原平衡的基础上增大压强;
(6)①根据Ksp(SrCO3)小于Ksp(SrSO4),则天青石矿粉与Na2CO3溶液搅拌混匀、加热发生反应生成SrCO3和硫酸钠;
②当转化完成时,根据Ksp(SrCO3)计算c(Sr2+),再根据Ksp(SrSO4)计算c(SO42-).
解答 解:(1)热化学方程式表达的意义为:当2mol A2和1mol B2完全反应时,放出热量为akJ,而加入2mol A2和1mol B2达到平衡时,可逆反应没有完全进行,即释放的热量小于完全反应释放的热量,即b<a,
故答案为:>;
(2)相同条件下,2molC3达到平衡状态时,与加入2mol A2和1mol B2达建立完全相同的平衡状态,所以C3的浓度等于wmol•L-1;即从化学平衡状态到完全反应生成2molC3,放出热量为c kJ,则:b+c=a,故答案为:=;a=b+c;
(3)已知2A2(g)+B2(g)?2C3(g);△H=-a kJ/mol(a>0),反应是气体体积减小的放热反应,依据平衡移动原理分析,反应的反应速率增大,且平衡向正反应方向移动;
A.及时分离出C3气体,反应正向进行,但反应速率减小,故A不符合;
B.适当升高温度,加快反应速率,但平衡逆向进行,故B不符合;
C.增大B2的浓度,平衡正向进行,反应速率增大,故C符合;
D.选择高效催化剂,增大反应速率,但不改变平衡,故D不符合;
故答案为:C;
(4)恒温恒容下,正反应为气体物质的量减小的反应,平衡时压强减小,若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,等效为在原平衡的基础上增大压强,反应物转化率增大,生成C3比恒容时多,则放出的热量也多,故d>b,
故答案为:>;
(5)保持同一反应温度,在相同容器中,将起始物质改为4mol A2、2mol B2,等效为在原平衡的基础上增大压强,平衡正向移动,则平衡时A2的转化率变大,
故答案为:变大;
(6)①由Ksp(SrCO3)小于Ksp(SrSO4),则天青石矿粉与Na2CO3溶液搅拌混匀、加热发生反应生成SrCO3和硫酸钠,离子方程式为:SrSO4+CO32-═SrCO3+SO42-;故答案为:SrSO4+CO32-═SrCO3+SO42-;
②Ksp(SrSO4)=3.2×10-7,Ksp(SrCO3)=1.1×10-10,当转化完成时,混合液中c(CO32-)=1.0×10-3mol/L,
所以c(Sr2+)=$\frac{1.1×10{\;}^{-10}}{1.0×10{\;}^{-3}}$=1.1×10-7mol/L,c(SO42-)=$\frac{3.2×10{\;}^{-7}}{1.1×10{\;}^{-7}}$=2.91mol/L,
故答案为:2.91mol/L.
点评 本题考查较为综合,涉及等效平衡、影响平衡的因素、Ksp的计算等知识,难度中等,侧重于考查学生对基础知识的应用能力.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D |
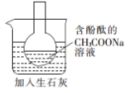 | 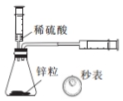 | 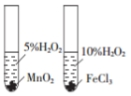 |  |
| 探究温度对盐的水解反应的影响 | 测定一定时间内生成H2的反应速率 | 比较不同催化剂对反应速率的影响 | 量取15.00mL稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
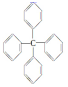 对该分子的描述,不正确的是( )
对该分子的描述,不正确的是( )| A. | 化学式为C25H20 | B. | 所有碳原子都在同一平面上 | ||
| C. | 此分子中有极性键和非极性键 | D. | 此物质属芳香烃类物质 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:填空题
(1)3 mol二氧化碳气体中,约含有 个二氧化碳分子;2molNH4+中共有 mol电子,与之电子数相等的H2O的质量是 ,这些水若完全电解,产生的氢气在标准状况下的体积为 L。
(2)相同质量的氧气、氢气、二氧化碳中,含有分子数目最少的是 (填化学式,下同),标准状况下体积最大的是 ,原子数最少的是 。
(3)在NaCl与MgCl2的混合液中,Na+与Mg2+的物质的量之比为1:2。如果混合液中共有0.5 mol Cl-,溶液的体积为0.5 L,则混合液中氯化钠的质量为 ;MgCl2的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
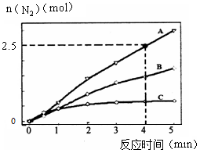 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
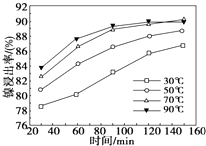 镍及其化合物具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.回答下列问题:
镍及其化合物具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL | B. | 20mL | C. | 360mL | D. | 36mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com