
| A. | 原子半径:X<Y<Z<W | |
| B. | Z的氢化物中只含离子键 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X和W两种元素形成的化合物,既能与强酸反应又能与强碱反应 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,X为O元素;Z原子的最外层电子数是其最内层电子数的$\frac{1}{2}$,Z为第三周期元素时,最外层电子数为1,可知Z为Na;W的最高正价和最低负价的代数和为0,则W为Si,结合原子序数可知Y为F,以此来解答.
解答 解:由上述分析可知,X为O,Y为F,Z为Na,W为Si,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:Y<X<W<Z,故A错误;
B.Z的氢化物为NaH,只含离子键,故B正确;
C.F无正价,不存在最高价氧化物对应水化物,故C错误;
D.X和W两种元素形成的化合物为二氧化硅,不能与强酸反应,但能与强碱反应,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 测定HCl和NaOH中和反应的反应热时,单次实验均应测量3个温度,即盐酸起始温度、NaOH溶液起始温度和反应终止温度 | |
| B. | 若2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol,则碳的燃烧热为110.5KJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知I:反应H2(g)+Cl2(g)=2HCl(g);△H=-akJ/mol II:  且a、b、c均大于零,则断开1molH-Cl键所需的能量为2(a+b+c)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
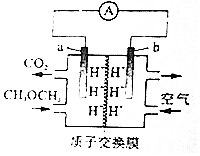
| A. | a极区域溶液的pH变大 | |
| B. | b极有H2O生成 | |
| C. | a极反应式:CH3OCH3+3O2--12e-═2CO2↑+6H+ | |
| D. | 每消耗11.2LO2(标准状况).有2molH+向左侧移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M可能是甲醛,也可能是乙醛 | |
| B. | 混合物中必有乙醛,其物质的量为0.06mol | |
| C. | 不能判断出N是何种醛,但其物质的量是0.06mol | |
| D. | M一定是甲醛,N一定是丙醛,其物质的量之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.4 mol/(L•s) | B. | v(B)=0.8 mol/(L•s) | C. | v(C)=1.2 mol/(L•s) | D. | v(D)=0.7 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O中含的质子数为10 NA | |
| B. | 12 g金刚石含有的电子数为4 NA | |
| C. | 46 g NO2和N2O4混合气体中含有原子总数为3 NA | |
| D. | 23 g Na 与足量 O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com