
| A. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | KNO3晶体(NaCl),蒸馏水,结晶 | |
| D. | C2H5OH(水),加足量CaO,蒸馏 |
分析 A.H2SO4和BaCl2溶液反应生成硫酸钡沉淀,但产生新的杂质;
B.二氧化硫能被酸性高锰酸钾溶液氧化生成硫酸,浓硫酸具有吸水性;
C.硝酸钾的溶解度受温度影响大,而NaCl的溶解度受温度影响不大,可以采用重结晶方法分离二者;
D.水和CaO反应生成氢氧化钙,乙醇和CaO不反应.
解答 解:A.H2SO4和BaCl2溶液反应生成硫酸钡沉淀,但产生新的杂质HCl,应该用适量Ba(NO3)2溶液除去硫酸杂质,然后采用过滤方法分离,故A错误;
B.二氧化硫能被酸性高锰酸钾溶液氧化生成硫酸,二氧化碳和高锰酸钾溶液不反应,浓硫酸具有吸水性,利用浓硫酸干燥气体,所以能除杂且方法正确,故B正确;
C.硝酸钾的溶解度受温度影响大,而NaCl的溶解度受温度影响不大,则利用冷却、结晶法分离,故C正确;
D.水和CaO反应生成氢氧化钙,乙醇和CaO不反应,然后采用蒸馏方法分离,故D正确;
故选A.
点评 本题考查物质分离和提纯,为高频考点,明确物质性质是解本题关键,利用物质差异性选取合适的除杂剂,难点是除杂剂的选取,知道常见物质分离提纯方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
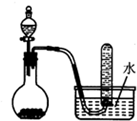
| A. | 浓盐酸和二氧化锰反应制取Cl2 | B. | 稀硫酸和大理石反应制取CO2 | ||
| C. | 浓硝酸与铜反应制取NO2 | D. | 二氧化锰固体和双氧水反应制取O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
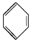 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$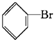 +HBr.
+HBr.| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L苯的分子数约为NA个 | |
| B. | 常温下,在1moLC5H12中含有共价键数15NA | |
| C. | 标准状况下,17g NH3所含共价键数为NA个 | |
| D. | 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 金属 | 冶炼原理 | |
| A | Fe | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 |
| B | Hg | 2HgO $\frac{\underline{\;\;△\;\;}}{\;}$ 2Hg+O2↑ |
| C | Al | 2AlCl3(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Al+3Cl3↑ |
| D | Na | 2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Na+Cl2↑ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
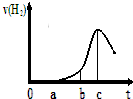 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
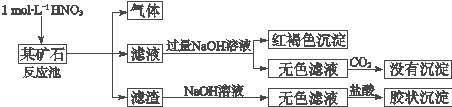
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg与水反应产生碱和氢气,Fe与在一定条件下水反应也生成碱和氢气 | |
| B. | CaC2能水解:CaC2+2H2O═Ca(OH)2+C2H2↑;则Al4C3也能水解:Al4C3+12H2O═4Al(OH)3↓+3CH4↑ | |
| C. | Fe能置换硫酸铜溶液的铜;则Na也能置换硫酸铜溶液的铜 | |
| D. | 工业上电解熔融MgCl2的制取金属镁;则也可以用电解熔融AlCl3的制取金属铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com