
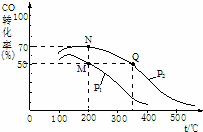
 Ŀǰ���п���������ԭ��֮һ�ǻ�����β����ȼú������������NO��CO��Ϊ����β���ijɷ֣������������ڴ�ת�����з������·�Ӧ��
Ŀǰ���п���������ԭ��֮һ�ǻ�����β����ȼú������������NO��CO��Ϊ����β���ijɷ֣������������ڴ�ת�����з������·�Ӧ������ ��1������v=$\frac{��c}{��t}$����v��N2��������������֮�ȵ��ڻ�ѧ������֮�ȼ���v��NO�����ٸ���n=��c��V����μӷ�ӦCO�����ʵ�������������CO��ת���ʣ�
��2��15min����ƽ�⣬��n��CO2��=��n��CO��=��1.2mol/L-0.8molL����2L=0.8mol��CO2��KOH���ʵ���֮��Ϊ2��3����Ӧ����KHCO3��K2CO3�����ݵ���غ㣺c��K+��+c��H+��=2��CO32-��+c��HCO3-��+c��OH-�����������غ��֪��2c��K+��=3[c��CO32-��+c��HCO3-��+c��H2CO3��]��
��3��a����С���������ѹǿ����ƽ��������Ӧ�����ƶ����ƶ������������COŨ������
b���������������ѹǿ��С��ƽ�����淴Ӧ�����ƶ���ƽ��ʱCOŨ�ȼ�С��
c������NO������ƽ�������ƶ���
d�������¶ȣ�ƽ��������Ӧ�����ƶ���
e������CO������CO��Ũ������
f��ʹ�ô���ƽ�ⲻ�ƶ���
��4���¶Ȳ��䣬ƽ�ⳣ�����䣬����ƽ��ʱ����ֵ�Ũ�ȣ�����K=$\frac{{c}^{2}��C{O}_{2}����c��{N}_{2}��}{{c}^{2}��NO����{c}^{2}��CO��}$����ƽ�ⳣ�����ټ����ʱŨ����Qc����Qc=K������ƽ��״̬����Qc��K����Ӧ������Ӧ���У���Qc��K����Ӧ���淴Ӧ���У�
��� �⣺��1����ͼ��֪��15min N2��Ũ�ȱ仯��Ϊ0.2mol/L������֮�ȵ��ڻ�ѧ������֮�ȣ���v��NO��=2v��N2��=2��$\frac{0.2mol/L}{15min}$=0.0267mol/��L•min�����μӷ�Ӧ��COΪ2L����1.2-0.8��mol/L=0.8mol����CO��ת����Ϊ$\frac{0.8mol}{2mol}$��100%=40.0%��
�ʴ�Ϊ��0.0267mol/��L•min����40.0%��
��2��15min����ƽ�⣬��n��CO2��=��n��CO��=1.2mol-0.8mol=0.4mol��CO2��KOH���ʵ���֮��Ϊ1��3����Ӧ����KHCO3��K2CO3�����ݵ���غ㣺c��K+��+c��H+��=2��CO32-��+c��HCO3-��+c��OH-�����������غ��֪��2c��K+��=3[c��CO32-��+c��HCO3-��+c��H2CO3��]�������ɵã���CO32-��-c��HCO3-��=2c��H+��-2c��OH-��+3c��H2CO3����
�ʴ�Ϊ��2c��H+��-2c��OH-��+3c��H2CO3����
��3��a����С���������ѹǿ����ƽ��������Ӧ�����ƶ����ƶ������������COŨ������ƽ��ʱCOŨ������a��ȷ��
b���������������ѹǿ��С��ƽ�����淴Ӧ�����ƶ�����ƽ��ʱCOŨ�ȼ�С����b����
c������NO������ƽ�������ƶ���COŨ�ȼ�С����c����
d�������¶ȣ�ƽ��������Ӧ�����ƶ���COŨ�ȼ�С����d����
e������CO������CO��Ũ������e��ȷ��
f��ʹ�ô���ƽ�ⲻ�ƶ���COŨ�Ȳ��䣬��f����
��ѡ��ae��
��4��ƽ��ʱ����Ũ�ȱ仯��Ϊ0.2mol/L��NO����ʼŨ��Ϊ$\frac{2mol}{2L}$=1mol/L��CO����ʼŨ��Ϊ$\frac{2.4mol}{2L}$=1.2mol/L����
2NO��g��+2CO��g��?2CO2��g��+N2��g��
��ʼ��mol/L����1 1.2 0 0
ת����mol/L����0.4 0.4 0.4 0.2
ƽ�⣨mol/L����0.6 0.8 0.4 0.2
��ƽ�ⳣ��K=$\frac{{c}^{2}��C{O}_{2}����c��{N}_{2}��}{{c}^{2}��NO����{c}^{2}��CO��}$=$\frac{0��{4}^{2}��0.2}{0��{6}^{2}��0��{8}^{2}}$L/mol=$\frac{5}{36}$L/mol=0.139L/mol��
20minʱ���������г���CO��CO2��0.4mol����ʱŨ����Qc=$\frac{��0.4+\frac{0.4}{2}��^{2}��0.2}{0��{6}^{2}����0.8+\frac{0.4}{2}��^{2}}$=0.2��K=0.139���ʷ�Ӧ���淴Ӧ���У��������ƶ���
�¶Ȳ��䣬ƽ�ⳣ�����䣬�����´ﵽƽ��÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ0.139L/mol��
�ʴ�Ϊ������0.139L/mol��
���� ���⿼�黯ѧƽ�������Ӱ�����ء���ѧ��Ӧ���ʵļ��㡢ƽ�ⳣ��������Ӧ�á�����Ũ�ȴ�С�Ƚϵȣ��Ƕ�ѧ���ۺ������Ŀ��飬��Ҫѧ���߱���ʵ�Ļ��������Ӧ���������Ѷ��еȣ�


 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д� �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������Ⱦ������������ȫ���������ŵĿ��⣮��ش��������⣺
������Ⱦ������������ȫ���������ŵĿ��⣮��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
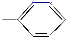 ��-COOH���ֻ���������϶��ɵĻ������У���ˮ��Һ��ʹʯ������У�������
��-COOH���ֻ���������϶��ɵĻ������У���ˮ��Һ��ʹʯ������У�������| A�� | 5�� | B�� | 4�� | C�� | 3�� | D�� | 2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
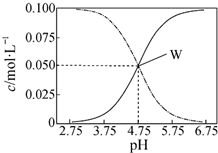
| A�� | pH=5.5��Һ�У�c��CH3COOH����c��CH3COO-����c��H+����c��OH-�� | |
| B�� | W���ʾ��Һ�У�c��Na+���Tc��CH3COO-��+c��CH3COOH�� | |
| C�� | pH=3.5��Һ�У�c��Na+��+c��H+��-c��OH-��+c��CH3COOH��=0.1mol•L-1 | |
| D�� | ��W������ʾ��1.0L��Һ��ͨ��0.05molHCl���壨��Һ����仯�ɺ��ԣ���c��H+���Tc��CH3COOH��+c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ͬ�����£���1mol��ԭ�������е�����ΪE1��1mol����Ӿ��е�����ΪE2����2E1��E2 | |
| B�� | ��֪4A��g��+5B��g��?4C��g��+6D��g����H��0����ƽ���������������A��B����H���С | |
| C�� | Ũ������ˮϡ�����Ƿ��ȵģ�����ϡ��Ũ������һ�����ȷ�Ӧ�� | |
| D�� | ����Ƭ��ϡ���ᷴӦ��ȡ����ʱ������98%��Ũ������Լӿ�������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Mg2+ | B�� | Ba2+ | C�� | Na+ | D�� | S2- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�ӽṹģ���ݱ������¬ɪ������˴��˵�ԭ�ӽṹģ�� | |
| B�� | ��仯ѧ�����շ�����������Ӣ����ѧ�Ҵ�άȷ�������������� | |
| C�� | Ӣ����ѧ�Ҵ�ά�״���ʵ�����Ƶ��˽����� | |
| D�� | �ҹ�����ר�Һ�°��������Ȼ��Ʊ�����Һ��ͨ��CO2��ȡ����ķ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com