

 ;装置Ⅰ是NaClO3和Na2SO3反应生成Na2SO4,ClO2,依据元素化合价变化发生反应的还原剂为Na2SO3;
;装置Ⅰ是NaClO3和Na2SO3反应生成Na2SO4,ClO2,依据元素化合价变化发生反应的还原剂为Na2SO3; ;Na2SO3;
;Na2SO3;| 11.2L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、用溴的四氯化碳溶液除去甲烷中混有的少量乙烯气体 |
| B、向淀粉溶液中加入稀硫酸,加热几分钟,冷却后再加入少量新制Cu(OH)2浊液,加热,没有红色沉淀生成,说明淀粉还没有发生水解 |
| C、用硝酸酸化的AgNO3溶液检验CCl4中是否含有氯元素 |
| D、红热的铜丝可以和乙醇发生置换反应产生氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,正反应速率减小,逆反应速率增加,平衡逆向移动 |
| B、升高温度,可提高CO2转化率 |
| C、增加H2的浓度,可提高CO2转化率 |
| D、改用高效催化剂,可增大反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐酸体积 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| A产生CO2的体积 | 0 | 0 | 0 | 0 | 0 | 22.4 | 44.8 | 44.8 | 44.8 |
| B产生CO2的体积 | 0 | 0 | 22.4 | 44.8 | 67.2 | 89.6 | x | x | x |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某实验B小组测定金属锡合金样品的纯度(仅含少量锌和铜,组成均匀),将样品溶于足量盐酸:Sn+2HCl=SnCl2+H2↑,过滤,洗涤.将滤液和洗涤液合并再加过量的
某实验B小组测定金属锡合金样品的纯度(仅含少量锌和铜,组成均匀),将样品溶于足量盐酸:Sn+2HCl=SnCl2+H2↑,过滤,洗涤.将滤液和洗涤液合并再加过量的查看答案和解析>>
科目:高中化学 来源: 题型:

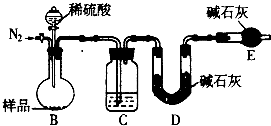
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| B、FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O |
| C、大理石溶于醋酸中的反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、等物质的量的NaHCO3和Ca(OH)2溶液混合:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某钾盐中加入澄清石灰水 | 有白色沉淀生成 | 该钾盐是K2CO3 |
| B | 在酸性KMnO4溶液中通入SO2 | 酸性KMnO4溶液褪色 | SO2具有漂白性 |
| C | 向溶液X中先滴加稀硝酸,再滴加硝酸钡溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| D | 向装有Fe(NO3)2溶液的试管中加入稀硫酸 | 在管口看到红棕色气体 | 氧化还原生成NO被氧化成NO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com