
| A. | 烧杯中一定有铜,可能有铁 | |
| B. | 烧杯中铁铜都有 | |
| C. | 溶液中一定有Fe2+,可能有Cu2+、Fe3+ | |
| D. | 烧杯中有铁无铜 |
分析 Fe3+、Cu2+的氧化性强弱为:Fe3+>Cu2+,Fe3+优先反应,固体有剩余,则反应后的溶液中一定不存在Fe3+;若剩余固体只有Cu,则反应后的溶液中一定Fe3+存在,一定存在Fe2+,可能含有Cu2+;若有Fe剩余,一定有铜生成,Fe3+和Cu2+无剩余,以此解答该题.
解答 解:①当固体为铁、铜时,溶液中的Fe3+、Cu2+全部参加反应生成Fe2+和Cu,反应的方程式为:2FeCl3+Fe=3FeCl2、CuCl2+Fe=Cu+FeCl2,所以溶液中一定没有Fe3+、Cu2+,一定含有Fe2+;
②当固体为铜时,溶液中一定没有Fe3+,Cu2+恰好全部参加反应或部分反应生成Fe2+和Cu,所以溶液中一定没有Fe3+,可能含有Cu2+,一定含有Fe2+.
A.若铁过量,剩余的固体为铜和铁的混合物,如铁不足,则只含有铜,故A正确;
B.如铁不足,则固体只能为铜,故B错误;
C.固体有剩余,Fe3+、Cu2+的氧化性强弱为:Fe3+>Cu2+,Fe3+优先反应,溶液中一定存在Fe2+,因有固体剩余,则一定没有Fe3+,故C错误;
D.铁可置换出铜,则不可能剩余铁而没有铜,故D错误.
故选A.
点评 本题考查了Fe3+、Cu2+的氧化能力大小的比较,题目难度中等,正确判断Fe3+、Cu2+的氧化性强弱及固体的成分是解本题的关键,注意掌握铁离子与金属铜、铁反应的化学方程式.


科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| B. | 少量CO2气体通入苯酚钠溶液中:2 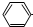 →O-+H2O+CO2→2 →O-+H2O+CO2→2 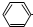 -OH+CO32- -OH+CO32- | |
| C. | 甲苯与浓硝酸和浓硫酸的混合物反应: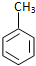 +3HNO3$→_{100℃}^{浓H_{2}SO_{4}}$ +3HNO3$→_{100℃}^{浓H_{2}SO_{4}}$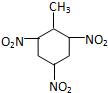 +3H2O +3H2O | |
| D. | 工业上通过苯与乙烯反应获得乙苯: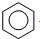 +CH2═CH2$→_{△}^{催化剂}$ +CH2═CH2$→_{△}^{催化剂}$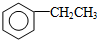 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | X | Y | Z | M |
| A | O2 | CO2 | CO | C |
| B | CH3CH2OH | CH3CHO | CH3COOH | O2 |
| C | NaOH | NaHCO3 | Na2CO3 | CO2 |
| D | NH3 | NO | NO2 | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(W)=3v(Z) | B. | 2v(X)=3v(Z) | C. | 2v(X)=v(Y) | D. | 2v(W)=3v(X) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯和聚乙烯完全燃烧生成的CO2分子数均为2NA | |
| B. | 25℃时,pH=3的1.0L NaHSO3溶液中,含Na+数目为0.001NA | |
| C. | 2.24LNH3中含共价键数目为0.3 NA | |
| D. | 78g苯含有C=C双键的数目为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
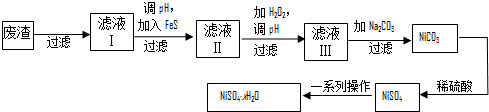
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com