
����Ŀ������������
��1��Fe3+���������ԣ�ʵ���Ҳⶨ�����Һ��I���ĺ����Ĺ������£���ȡ25.00mL��Һ��250mL��ƿ�У��ֱ����5mL 2molL��1 H2SO4��10mL 20% Fe2��SO4��3��Һ��ҡ�ȣ�С���������������ȫ������ȡ����ƿ��ȴ���뼸�ζ����������ƣ�����ָʾ��������0.02500molL��1��K2Cr2O7��Һ���еζ����յ㣮�ظ�3�Σ����ݼ�¼�����
���� | 1 | 2 | 3 |
����/mL | 19.98 | 20.02 | 19.00 |
��i����ʢ�з�Һ����ƿ���ȼ���5mL 2molL��1 H2SO4��Ŀ���� �� �������ӷ���ʽ�������������ͣ�
��ii�������������漰�ķ�Ӧ����2Fe3++2I���T2Fe2++I2�� ��
��iii�����ݵζ��й����ݣ��÷�Һ��I��������gL��1 ��
��iv���ڵζ������У����в���������������ȷ������ɲⶨ���ƫ�͵��� ��
A���յ����ʱ���Ӷ������ζ�ǰƽ�Ӷ���
B����ƿˮϴ�º�δ����
C���ζ���δ�ñ�K2Cr2O7��Һ��ϴ
D��ʢ��K2Cr2O7��Һ�ĵζ��ܣ��ζ�ǰ�����ݣ��ζ��������ݣ�
��2��Fe3+��Ag+�����������ǿ��һֱ��ʵ��̽�����ȵ㣮ijѧϰС��ͬѧ�������ʵ�飺
ʵ���� | ʵ����� | ���� |
1 | ��10mL 3mol/L KNO3������Һ��pH=1���в���һ���ྻ��Ag˿�����μ�NaCl��Һ | �ް�ɫ�������� |
2 | ��10mL 1mol/L AgNO3��Һ�еμ�2mL 0.1mol/L FeSO4��Һ�����ٵμ�����KMnO4��Һ | �Ϻ�ɫ����ȥ |
3 | ��10mL 1mol/L Fe��NO3��3������Һ��pH=1���в���һ���ྻ��Ag˿�����μ�NaCl��Һ | �а�ɫ�������� |
��ش�
��i�����ʵ��ٵ�Ŀ���� ��
��ii��ʵ��ۿɵó������� ��
��iii��д��ʵ����з�Ӧ�����ӷ���ʽ
��iv����������ʵ�飬Fe3+��Ag+�����������ǿ���������йأ�
���𰸡�
��1��Fe3++3H2O?Fe��OH��3+3H+ �� ����H2SO4ƽ�������ƶ�������Fe3+ˮ�⣻6Fe2++Cr2O72��+14H+�T6Fe3++2Cr3++7H2O��15.24��A
��2���ų�NO3���ĸ��ţ�Fe3+������Ag��Fe2++Ag+?Fe3++Ag��Ũ��
���������⣺��1����i����ʢ�з�Һ����ƿ���ȼ���5mL 2molL��1 H2SO4��Ŀ���ǣ���Һ��������ˮ����Һ�����ԣ�Fe3++3H2OFe��OH��3+3H+ �� ����H2SO4ƽ�������ƶ�������Fe3+ˮ�⣬���Դ��ǣ�Fe3++3H2OFe��OH��3+3H+ �� ����H2SO4ƽ�������ƶ�������Fe3+ˮ�⣻��ii��ȡ����ƿ��ȴ���뼸�ζ����������ƣ�����ָʾ��������0.02500molL��1��K2Cr2O7��Һ���еζ����յ㣮�ظ������������Һ��������������Ϊ�����ӣ������������漰�ķ�Ӧ����2Fe3++2I���T2Fe2++I2 �� ��6Fe2++Cr2O72��+14H+�T6Fe3++2Cr3++7H2O��
���Դ��ǣ�6Fe2++Cr2O72��+14H+�T6Fe3++2Cr3++7H2O����iii������������ԭ��Ӧ������ϵ���㣬2Fe3++2I��=2Fe2++I2 �� 6Fe2++Cr2O72��+14H+�T6Fe3++2Cr3++7H2O��6I����6Fe2+��Cr2O72����3�βⶨ��Һ�����3��������ȥ�룬������Һ���ΪV= ![]() ml=20.00ml��
ml=20.00ml��
6I�� | �� | 6Fe2+ | �� | Cr2O72�� |
6 | 1 | |||
n | 0.02500molL��1��0.0200L |
n=0.003mol��
�÷�Һ��I������= ![]() =15.24g/L��
=15.24g/L��
���Դ��ǣ�15.24����iv�����ݵζ����̷����������Ҫ�DZ���Һ����仯����c�����⣩= ![]() ��
��
A���յ����ʱ���Ӷ������ζ�ǰƽ�Ӷ�������ȡ�ı���Һ�����С���ⶨ���ƫ�ͣ���A��ȷ��
B����ƿˮϴ��δ����Դ���Һ��������Ӱ�죬��B����
C���ζ���δ�ñ�K2Cr2O7��Һ��ϴ�����ı���Һ������ⶨ���ƫ�ߣ���C����
D��ʢ��K2Cr2O7��Һ�ĵζ��ܣ��ζ�ǰ�����ݣ��ζ��������ݣ���ȡ����Һ������ⶨ���ƫ�ߣ���D����
���Դ��ǣ�A��
����2����i������ʵ�����֤�����������������Һ�к�����������Ӧ�����ʵ��ٵ�Ŀ�����ų�NO3���ĸ��ţ�
���Դ��ǣ��ų�NO3���ĸ��ţ���ii����10mL 1mol/L Fe��NO3��3������Һ��pH=1���в���һ���ྻ��Ag˿�����μ�NaCl��Һ���а�ɫ�������ɣ��������Ȼ��ƺ����������ɵ��Ȼ�����ɫ������֤���������������������������ӣ�˵��Fe3+������Ag��
���Դ��ǣ�Fe3+������Ag����iii����10mL 1mol/L AgNO3��Һ�еμ�2mL 0.1mol/L FeSO4��Һ�����ٵμ�����KMnO4��Һ���Ϻ�ɫ����ȥ˵����Һ�����������ӣ�˵���������Ӻ������ӷ�����Ӧ���������Ӻ�������Ӧ�����ӷ���ʽΪ��Fe2++Ag+Fe3++Ag��
���Դ��ǣ�Fe2++Ag+Fe3++Ag����iv����������ʵ�飬Fe3+��Ag+�����������ǿ��������Ũ���йأ�
���Դ��ǣ�Ũ�ȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������Ļ����15�ˣ�����150mLϡ�����У�����·ų�����1.68����ͬʱ��������������ʣ�࣬����Һ�еμ�KSCN��Һ��δ����ɫ�仯��
��1�����������������Ϊg��
��2��ΪʹFe2��ȫת��ΪFe��OH��2 �� ������3molL��1������������Һ200mL����ԭ��������ʵ���Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��ɫ����������Һ�У��ܹ����������������
A. NH4+��NO3-��A13����Cl- B. Na����Fe2����K+��NO3-
C. MnO4-��K����SO42-��Na+ D. K����SO42-��HCO3-��Na+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������H������ң����ٴ����õ���ʹ����ҩ����ϳ�·�����£����ַ�Ӧ�������Լ��ԣ���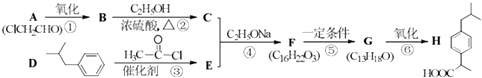
��֪����i�� ![]() ��R1��R2���������
��R1��R2���������
��ii�� ![]() +ClCH2COOR4+R4ONa��
+ClCH2COOR4+R4ONa�� ![]() COOR4+R4OH+NaCl��R3��R4���������
COOR4+R4OH+NaCl��R3��R4���������
��ش��������⣺
��1��������H�ķ���ʽ�� �� ������B�Ĺ����������� �� �ڢ۲��Ļ�ѧ��Ӧ������ ��
��2���ڢڲ���Ӧ�Ļ�ѧ����ʽ�� ��
��3��������G�Ľṹ��ʽ�� ��
��4���ڢܲ���Ӧ�Ļ�ѧ����ʽ�� ��
��5��ͬʱ��������������H������ͬ���칹��Ľṹ��ʽ�� ��
I���ṹ���б������ީ�O��O����II���˴Ź�������Ϊ4��壬�����֮��Ϊ2��2��1��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ����,������������ȷ����
A. ����ʵ��֮ǰ���뼸����ʯB. ���¶ȼ�ˮ�����������ˮ��
C. ��ˮ���������¿���,�Ͽڳ�D. �ռ�����ˮʱ,Ӧ��ȥ��ʼ����IJ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���������Ӧ�ĵ�λ����������(����)
A. Ħ������g/molB. ����Ħ�����L/mol
C. ����٤������ mol / NAD. �ܶ�g/cm3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���������ͼ��ʾת����ϵ���ǣ� ��
ѡ�� | �� | �� | �� | �� |
A | NH3 | Cl2 | N2 | H2 |
B | Fe | H2O | Fe2O3 | CO |
C | Al��OH��3 | NaOH | NaAlO2 | CO2 |
D | Br2 | FeCl2 | FeBr3 | Cl2 |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������㷺Ӧ������ҩ�ͻ�����ҵ��ijͬѧ�����üױ���������Ӧ�Ʊ������ᣮ ��Ӧԭ����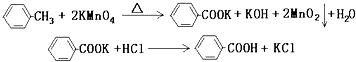
ʵ�鷽����һ�����ļױ���KMnO4��Һ�� 100�淴Ӧһ��ʱ���ֹͣ��Ӧ�����������̷����������ͻ���δ��Ӧ�ļױ���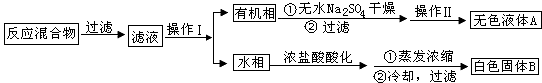
��֪�������������122���۵� 122.4�棬�� 25��� 95��ʱ�ܽ�ȷֱ�Ϊ0.3g��6.9g�����������л���һ�㶼�й̶��۵㣮
��1��������Ϊ �� ������Ϊ ��
��2����ɫҺ��A��
��3���ⶨ��ɫ����B���۵㣬��������115�濪ʼ�ۻ����ﵽ130��ʱ�����������ۣ� ��ͬѧ�Ʋ��ɫ����B�DZ�����������KCl�Ļ���
�����ӻ�������ᴿ�����ᣬӦ���еIJ����� �� ������̰�����������������ˮ���������ˡ�ϴ�ӡ����
���ڢ��ᴿ�����У�Ӧ���Ծ������ϴ�ӣ�ϴ�ӵ�Ŀ���� �� ��μ���ϴ���Ѿ���ȫ�� ��
�������龭�����ᴿ��Ĺ����Ƿ������Բ��õ�ʵ�鷽���� �� ������崿������Ӧ��������
��4�����ᴿ��ı�������к˴Ź��������������Եõ��ַ壬�����֮��Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com