
| 元素 | 相关信息 |
| X | X单质分子中σ键和π键数目之比为1:2 |
| Y | Y 基态原子的最外层电子排布式为 nsnnpn+2 |
| Z | Z的第一电离能在同周期主族元素中最小 |
| W | W的氧化物是导致酸雨的主要物质之一 |
| R | 基态原子的核外电子排布中未成对的电子数最多 |
分析 X、Y、Z、W、R是五种常见的前四周期元素,原子序数依次增大,X单质分子中σ键和π键数目之比为1:2,则X为氮元素,Y 基态原子的最外层电子排布式为 nsnnpn+2,则n=2,所以Y为氧元素,W的氧化物是导致酸雨的主要物质之一,且W的原子序数大于氧,所以W为硫元素,Z的第一电离能在同周期主族元素中最小,则Z应在第ⅠA族,Z的原子序数介于Y、W之间,所以Z为钠元素,R基态原子的核外电子排布中未成对的电子数最多,R的原子序数大于硫,则R应在第四周期,所以R为铬元素,据此答题.
解答 解:X、Y、Z、W、R是五种常见的前四周期元素,原子序数依次增大,X单质分子中σ键和π键数目之比为1:2,则X为氮元素,Y 基态原子的最外层电子排布式为 nsnnpn+2,则n=2,所以Y为氧元素,W的氧化物是导致酸雨的主要物质之一,且W的原子序数大于氧,所以W为硫元素,Z的第一电离能在同周期主族元素中最小,则Z应在第ⅠA族,Z的原子序数介于Y、W之间,所以Z为钠元素,R基态原子的核外电子排布中未成对的电子数最多,R的原子序数大于硫,则R应在第四周期,所以R为铬元素,
(1)W为硫元素,元素W在周期表中的位置是第三周期,第ⅥA族,R为铬元素,R基态原子的价电子排布式为3d54s1,
故答案为:第三周期,第ⅥA族;3d54s1;
(2)Y为氧元素,X为氮元素,由于氮最外层电子处于半满状态,是一种稳定结构,所以氧的电离能比氮的小,Y的最简单氢化物为水,水分子之间有氢键,所以由液态变为气态所需克服的微粒间作用力是氢键,
故答案为:小;氢键;
(3)ZX3为NaN3,撞击会产生一种离子化合物氮化钠和一种气态单质氮气,该反应的化学方程式是3NaN3=Na3N+4N2↑,
故答案为:3NaN3=Na3N+4N2↑;
(4)酸性条件下Cr2O72-与Fe2+反应的离子方程式为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
(5)W为硫元素,Y为氧元素,已知在25℃、101KPa时:①2Cu(s)+W(s)=Cu2W(s)△H=-79.5KJ/mol,②W(s)+Y2(g)=WY2(g)△H=-296.6KJ/mol,根据盖斯定律,将②-①可得Cu2W与Y2反应生成Cu与WY2的热化学方程式为Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.1KJ/mol,
故答案为:Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.1KJ/mol.
点评 本题考查较综合,根据原子结构结合元素周期律来确定元素,正确推断元素是解本题关键,注意离子方程式和热化学方程式的规范书写,难度中等.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 因为放在烧杯中称量比放在纸上称量更准确 | |
| B. | 因为配制溶液是在烧杯中进行,直接放在烧杯中称量会减少操作过程 | |
| C. | 因NaOH易潮解且有强腐蚀性 | |
| D. | 因为放在纸上称量会混有杂质,降低所配制溶液的纯度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水,酒精和水,苯酚和水 | B. | 二溴乙烷和水,溴苯和水,酒精和水 | ||
| C. | 甘油和水,乙醛和水,乙酸和乙醇 | D. | 苯和水,甲苯和水,己烷和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含质子数和电子数相等的微粒一定是原子 | |
| B. | 两种微粒如果核外电子排布相同,化学性质就一定相同 | |
| C. | 质量数相同的原子其化学性质一定相同 | |
| D. | 具有相同核电荷数的原子或单核离子一定是同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
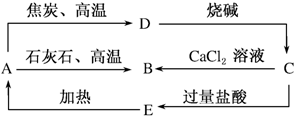
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
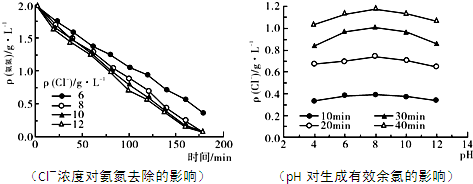
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
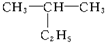 命名为“2-乙基丙烷”,错误原因是主链选错;将其命名“3-甲基丁烷”,错误原因是编号错误.正确的命名为2-甲基丁烷.
命名为“2-乙基丙烷”,错误原因是主链选错;将其命名“3-甲基丁烷”,错误原因是编号错误.正确的命名为2-甲基丁烷.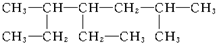 的名称为2,5-二甲基-4-乙基庚烷.
的名称为2,5-二甲基-4-乙基庚烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②⑤ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )| A. | 该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管 | |
| B. | 取10 mL该硫酸于烧杯中,再加18.4 mL的水,可配得49%的硫酸 | |
| C. | 配制200 mL 4.6 mol•L-1的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com