
|
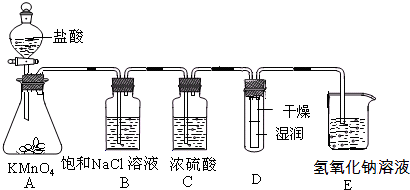
已知KMnO4与浓HCl在常温下反应能产生Cl2.若用如图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应.每个虚线框表示一个单元装置,其中有错误的是
| |
A. |
只有①和②处 |
B. |
只有②处 |
C. |
只有②和③处 |
D. |
只有②③④处 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川乐山一中高二下学期第二阶段考试化学卷 (带解析) 题型:填空题
按要求填空。
Ⅰ:已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_____________
Ⅱ:
【小题1】硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请用文字简要说明原因____________如何才能用热水配制出澄清的较浓的CuSO4溶液____________________;
【小题2】稀Na2S溶液有一种臭鸡蛋气味,加入AlCl3溶液后,臭鸡蛋气味加剧,用离子方程式表示气味加剧过程所发生的反应___________________________
III:依据氧化还原反应:MnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O,欲采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
①称量绿矾样品15.2g,配成100 mL待测溶液②取10.0ml待测液置于锥形瓶中,并加入一定量的硫酸③将0.1 mol?L-1的KMnO4溶液装入滴定管中,调节液面至8.00mL处④滴定待测液至滴定终点时,滴定管的液面读数18.00 mL
【小题3】如何知道滴定到达终点?
【小题4】下列操作会导致测定结果偏低的是
| A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定 |
| B.锥形瓶用蒸馏水洗涤后未用待测液润洗 |
| C.读取标准液读数时,滴定前平视,滴定到终点后俯视 |
| D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失 |
| A.托盘天平 | B.量筒 |
| C.碱式滴定管 | D.酸式滴定管 |
查看答案和解析>>
科目:高中化学 来源:2013届四川乐山一中高二下学期第二阶段考试化学卷(解析版) 题型:填空题
按要求填空。
Ⅰ:已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_____________
Ⅱ:
1.硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请用文字简要说明原因____________如何才能用热水配制出澄清的较浓的CuSO4溶液____________________;
2.稀Na2S溶液有一种臭鸡蛋气味,加入AlCl3溶液后,臭鸡蛋气味加剧,用离子方程式表示气味加剧过程所发生的反应___________________________
III:依据氧化还原反应:MnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O,欲采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
①称量绿矾样品15.2g,配成100 mL待测溶液②取10.0ml待测液置于锥形瓶中,并加入一定量的硫酸③将0.1 mol•L-1的KMnO4溶液装入滴定管中,调节液面至8.00 mL处④滴定待测液至滴定终点时,滴定管的液面读数18.00 mL
3.如何知道滴定到达终点?
4.下列操作会导致测定结果偏低的是
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
5.下列每种量器的数量不限,在上述实验中,必须使用的有
A.托盘天平 B.量筒 C.碱式滴定管 D.酸式滴定管 E容量瓶
6.FeSO4的质量分数为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com