
 电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子.P、Q为电解池的两电极,分子不能穿过离子交换膜).
电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子.P、Q为电解池的两电极,分子不能穿过离子交换膜).分析 (1)A-通过阴离子交换膜到左侧生成HA,说明在Q电极上阳离子放电,剩余A-,阳离子在阴极放电;
(2)电解池中阳极上氢氧根离子失电子生成氧气;
(3)根据电极反应式结合原子守恒来计算.
解答 解:(1)A-通过阴离子交换膜到左侧生成HA,说明在Q电极上阳离子放电,剩余A-,阳离子在阴极放电,所以Q为阴极,故答案为:阴;
(2)阳极上是阴离子氢氧根离子发生失电子的氧化反应,电极反应式为:4OH--4e-═2H2O+O2↑,故答案为:4OH--4e-═2H2O+O2↑;
(3)在阳极上发生电极反应:4OH--4e-═2H2O+O2↑,阴极上发生电极反应:2H++2e-=H2↑,根据电极反应方程式,则有:HA~H+~$\frac{1}{2}$H2,根据差值法,乳酸的浓度变化量是$\frac{145g/L-10g/L}{90g/mol}$=1.5mol/L,即生成HA的物质的量是1.5mol/L×0.4L=0.6mol,所以产生氢气是0.3mol即0.3mol×22.4L/mol=6.72L,
故答案为:6.72.
点评 本题涉及原电池的工作原理以及应用的考查,注意知识的迁移和应用是解题的关键,难度中等,注意把握电解池中离子的移动方向.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列化学用语正确的是
A.硫化钠的电子式: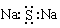
B.HClO4的电离方程式:HClO4 H++ClO4-
H++ClO4-
C.乙酸的结构简式:C2H4O2
D.Mg2+的结构示意图: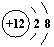
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2S2O3溶液中通入足量Cl2:S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+ | |
| B. | 向苯酚钠溶液中通入少量的CO2:CO2+2C6H5O-+H2O═2C6H5OH+CO32- | |
| C. | 草酸加入硫酸酸化的高锰酸钾溶液中:5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O | |
| D. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 用电子天平称量化学药品时,必须先称小烧杯的质量,再称量加入试剂后的总质量,两者之差即为药品的质量 | |
| C. | 金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,不可用泡沫灭火器灭火 | |
| D. | 在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,Cu(OH)2在水中的溶度积比其在Cu(NO3)2溶液中的大 | |
| B. | 氨水溶液加水稀释,电离程度增大,c(OH-)增大 | |
| C. | 25℃,为使100mlpH=2的醋酸溶液pH变为3,可加入900ml 水 | |
| D. | CH3COONa溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,反应类型为酯化反应;
,反应类型为酯化反应; ,反应5除生成氯吡格雷外,另一种产物的名称是HOCH2CH2OH;
,反应5除生成氯吡格雷外,另一种产物的名称是HOCH2CH2OH;查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 每个青藤碱分子中含有2个手性碳原子 | |
| B. | 1 mol青藤碱最多能与1 mol Br2发生反应 | |
| C. | 1 mol青藤碱最多能与4 mol H2发生反应 | |
| D. | 青藤碱既能与盐酸反应又能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉溶液、豆浆、雾、碳素墨水均可发生丁达尔现象 | |
| B. | 明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 | |
| C. | 火柴头的主要成分是氯酸钾和硫单质,分别属于电解质和非电解质 | |
| D. | 鸡蛋清溶液中加入CuSO4溶液,有沉淀析出,该性质可用于蛋白质的分离与提纯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com