
【题目】生活中经常用到物质分离提纯的方法,以下说法错误的是( )
A.海水淡化是利用蒸馏的原理
B.用过滤的原理使用纱布将豆腐花和豆浆分离
C.酿酒时用萃取的原理将酒精的纯度提高
D.海水晒盐使用了蒸发的原理
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 乙炔、乙烯、苯都能使溴水褪色,其褪色原理相同,都发生加成反应
B. 植物油通常呈液态,主要成分是高级脂肪酸甘油酯,不易发生变质
C. CH3COOCH2 ![]() 的同分异构体中含有苯环且属于羧酸的有13 种
的同分异构体中含有苯环且属于羧酸的有13 种
D. 蛋白质属于高分子化合物,在福尔马林作用下可发生变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表达不正确的是( )
①丙烷的球棍模型 ②丙烯的结构简式为CH3CHCH2
②丙烯的结构简式为CH3CHCH2
③某有机物的名称是2,3-二甲基戊烷 ④异戊烷与2-甲基丁烷互为同分异构体
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、T是原子序数依次增大的五种短周期元素,且X、Y、Z、W的原子序数之和为32。其中X是元素周期表中原子半径最小的元素,Y、Z左右相邻, Z、W位于同一主族。T的单质常用于自来水的杀菌消毒。
请回答下列问题:
(1) 写出W元素在周期表中的位置为________________。
(2) 由X、Y、Z、W四种元素中的三种组成一种强酸,该强酸的浓溶液只有在加热条件下能与金属铜反应,该反应的化学方程式为__________________。
(3) Y元素的气态氢化物与其最高价氧化物的水化物可以相互反应,写出其离子方程式:___________________。
(4) Y和T两元素的非金属性强弱为Y_________T (填“>” “<”或者“=”)。可以验证该结论的方法是____________。
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素所形成含氧酸的酸性
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素与氢气化合的难易程度
E.比较这两种元素气态氢化物的还原性
(5) 某化学兴趣小组欲通过实验探究元素N、C、Si非金属性强弱。实验装置如图:

①溶液a为_____________溶液、溶液b为___________溶液(均写化学式)。
②溶液C中反应的离子方程式为_____________________。
③经验证,N、C、Si的非金属性由强到弱为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短调期元素在周期表中的位置如图,其中只有M为金属元素。下列说法错误的是( )
![]()
A. Z位于元素周期表中第2周期、第ⅥA族
B. 原子半径Z<M
C. X的最简单气态氢化物的热稳定性比Z的小
D. Y的最高价氧化物对应水化物的酸性比X的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.气体摩尔体积就是22.4L
B.任何状况下,1mol任何气体的体积一定是22.4
C.标准状况下22.4L铁含有6.02×1023个分子
D.1molH2和O2的混合气体在标准状况下的体积约22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种香豆素衍生物,可以用作香料,其合成路线如下: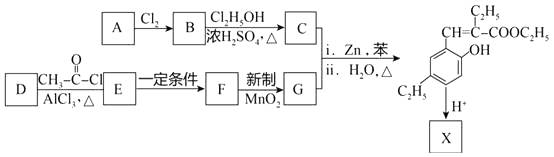
已知: 
(1)A所含官能团的名称是。
(2)B生成C反应的化学方程式是。
(3)G的结构简式是。
(4)F的结构简式是 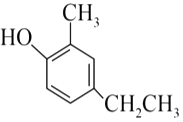 。D的分子式是C7H8O,与F互为同系物。D的结构简式是。
。D的分子式是C7H8O,与F互为同系物。D的结构简式是。
(5)X的分子式是C13H14O2 , X与足量NaOH溶液共热的化学方程式是。
(6)E可以经多步反应合成F,请写出一条可能的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和H2O。已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,CH4和SO2反应的热化学方程式为________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
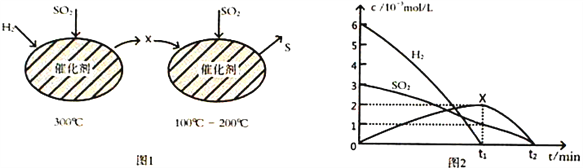
①分析可知X为____________(写化学式),0~t1时间段的温度为_________________,0~t1时间段用SO2 表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
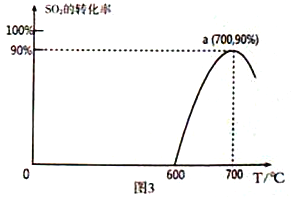
①该反应的ΔH_______________0 (填“>”或“<”)。
②计算a点的平衡常数为_______________________。
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为__________________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,乙醛可发生分解:CH3CHO(l)![]() CH4+CO,已知该反应的活化能为190kJ.mol-1,在含有少量I2的溶液中,该反应的机理为:
CH4+CO,已知该反应的活化能为190kJ.mol-1,在含有少量I2的溶液中,该反应的机理为:
反应Ⅰ:CH3CHO+ I2![]() CH3I2+HI+CO (慢)
CH3I2+HI+CO (慢)
反应Ⅱ:CH3I+HI![]() CH4+ I2
CH4+ I2
下列有关该反应的叙述中正确的是( )
A.反应速率与I2的浓度有关
B.HI在反应Ⅰ中是氧化产物
C.反应焓变的绝对值等于190kJ.mol-1
D.乙醛的反应速率主要取决于反应Ⅱ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com