
(12分)(1)25℃时,浓度为0.1 mol·L-1的6种溶液:
①HCl, ②CH3OOH, ③Ba(OH)2,④Na 2CO3,⑤KCl,⑥NH4Cl溶液
pH由小到大的顺序为_________________ _(填写编号)。
(2)25℃时,醋酸的电离常数Ka=1.7×10-5mol/L,则该温度下CH3COONa的水解平衡常数
Kh= mol ·L-1(保留到小数点后一位)。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈 (填“酸性”,“中性”或“碱性”),请写出离子浓度大小关系式: 。
(4)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-) + c(CH3COOH)= ,m与n的大小关系是m n(填“>”“=”或“<”)。
(1)①②⑥⑤④③ (2) 5.9×10-10 (3) 酸性 c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。(4) m/2 mol/L >
【解析】
试题分析:(1)①HCl是一元强酸, ②CH3OOH是一元弱酸, ③Ba(OH)2是二元强碱,④Na 2CO3是强碱弱酸盐,⑤KCl是强酸强碱盐,⑥NH4Cl是强酸弱碱盐。酸性:强酸大于弱酸大于强酸弱碱盐;碱性:碱的大于强碱弱酸盐的。所以这几种溶液pH由小到大的顺序为① ② ⑥ ⑤ ④ ③.
(2)KHAc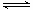 CH3COO-+H+,
CH3COO-+H+,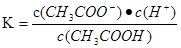 ,该温度下CH3COONa的水解平衡为CH3COO-+H2O
,该温度下CH3COONa的水解平衡为CH3COO-+H2O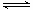 CH3COOH+OH-。
CH3COOH+OH-。
水解平衡常数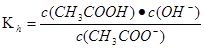


所以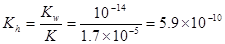 。(3)25℃时,pH=3的醋酸,c(H+)=10-3mol/L, pH=11的氢氧化钠溶液,c(H+)=10-11mol/L,则c(OH-)=Kw÷c(H+)=10-14÷10-11=10-3mol/L.两种溶液中的离子浓度相等。当等体积混合后,电离的部分巧合完全中和。但由于醋酸为弱酸。还有大量为电离的醋酸分子存在,会继续电离产生H+和CH3COO-。所以溶液呈酸性。在溶液中存在电荷守恒。c(Na+) + c(H+) = c(CH3COO-) + c(OH-)。(4)由于溶液为等体积混合,所以溶液中c(CH3COO-) + c(CH3COOH)=m/2mol/L。因为酸是弱酸,碱是强碱,若等物质的量混合,这恰好生成CH3COONa。溶液由于CH3COO-的水解二显碱性。为了使溶液显中性,酸必须稍微过量一些,来抵消醋酸根离子水解的碱性。所以m与n的大小关系是m>n. (5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7 ,说明醋酸与一水合氨的强弱程度相同。也就是电离程度相等。由于醋酸的电离平衡常数为Ka=1.7×10-5mol/L所以NH3·H2O的电离常数Ka=1.7×10-5mol/L。
。(3)25℃时,pH=3的醋酸,c(H+)=10-3mol/L, pH=11的氢氧化钠溶液,c(H+)=10-11mol/L,则c(OH-)=Kw÷c(H+)=10-14÷10-11=10-3mol/L.两种溶液中的离子浓度相等。当等体积混合后,电离的部分巧合完全中和。但由于醋酸为弱酸。还有大量为电离的醋酸分子存在,会继续电离产生H+和CH3COO-。所以溶液呈酸性。在溶液中存在电荷守恒。c(Na+) + c(H+) = c(CH3COO-) + c(OH-)。(4)由于溶液为等体积混合,所以溶液中c(CH3COO-) + c(CH3COOH)=m/2mol/L。因为酸是弱酸,碱是强碱,若等物质的量混合,这恰好生成CH3COONa。溶液由于CH3COO-的水解二显碱性。为了使溶液显中性,酸必须稍微过量一些,来抵消醋酸根离子水解的碱性。所以m与n的大小关系是m>n. (5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7 ,说明醋酸与一水合氨的强弱程度相同。也就是电离程度相等。由于醋酸的电离平衡常数为Ka=1.7×10-5mol/L所以NH3·H2O的电离常数Ka=1.7×10-5mol/L。
考点:考查离子浓度的大小比较、电离平衡常数与盐的水解平衡常数的关系、溶液的酸碱性


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源:2014-2015北京市高二上学期期中考试化学(文)试卷(解析版) 题型:选择题
下列有机物中,属于高分子化合物的是
A.油脂 B.蔗糖 C.葡萄糖 D.蛋白质
查看答案和解析>>
科目:高中化学 来源:2014-2015内蒙古满洲里市高二上学期第二次月考化学试卷(解析版) 题型:填空题
(14分)(1)常温下物质的量浓度相同的aHF、bNH3·H2O、c H2S溶液,电离常数分别为7.2ⅹ10-4、1.8ⅹ10-5和K1=9.1ⅹ10-8,K2=1.1ⅹ10-12。
①电解质的强弱顺序为__(填a、b、c)
②溶质分子浓度最小的是__(填a、b、c)
③氢离子浓度最小的是___(填a、b、c)
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH发生中和反应的中和热为_________,
表示该中和热的热化学方程式为___________。
(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应△H1、△H2、△H3的大小关系为 。
(4)已知下列反应的反应热:
①CH3COOH(l) + 2O2 (g)= 2CO2 (g)+ 2H2O(l) △H=-870.3kJ∕mol
②C(S) + O2 (g)= CO2 (g) △H=-393.5kJ∕mol
③2C(S) + 2H2 (g) + O2 (g)= CH3COOH(l) △H=-488.3kJ∕mol
请写出H2燃烧热的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015内蒙古满洲里市高二上学期第二次月考化学试卷(解析版) 题型:选择题
反应:xA(气)+yB(气) 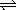 zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
A.x+y<z B.平衡向右移动
C.B的转化率升高 D.C的体积分数降低
查看答案和解析>>
科目:高中化学 来源:2014-2015内蒙古满洲里市高二上学期第二次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了放热还是吸热
D.吸热反应只有在加热条件下才能发生反应
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省高二1月月考化学试卷(解析版) 题型:选择题
下列表述正确的是
A.0.1mol·L-1Na2CO3溶液中:[OH-]=[HCO3-]+[H+]+[H2CO3]
B.0.1mol·L-1CH3COONa溶液中:[Na+]=[CH3COO-]+[OH-]
C.CH3COONa、NaOH和Na2CO3三种溶液的pH相同,则浓度大小顺序:c (NaOH) <c (Na2CO3) <c(CH3COONa)
D.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:[CH3COO-]>[Na+]>[OH-]=[H+]
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省高二1月月考化学试卷(解析版) 题型:选择题
某温度时,AgCl(s)  Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。

下列说法正确的是
A.加入AgNO3,可以使溶液由c点变到d点
B.加入少量水,平衡右移,Cl-浓度减小
C.d点没有AgCl沉淀生成
D.c点对应的Ksp等于a点对应的Ksp
查看答案和解析>>
科目:高中化学 来源:2014-2015重庆市高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.加入氯化钡溶液有白色沉淀生成,再加稀盐酸,沉淀不消失,一定有硫酸根离子
B.Na2O2与CO2反应,Na2O2是氧化剂、CO2是还原剂
C.向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液 →白色沉淀→灰绿色沉淀→红褐色沉淀
D.称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液,则放出氢气的体积(同温同压下)不相等
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省长沙市望城区高二上学期期末化学文科试卷(解析版) 题型:选择题
将下列物质分别加入鸡蛋清中,会发生蛋白质变性的是
A.白糖水 B.硝酸铅(重金属盐)溶液
C.食盐水 D.硫酸铵溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com