
| A. | 向水中投入一小块金属钠 | B. | 向水中通入二氧化硫气 | ||
| C. | 将水加热煮沸 | D. | 向水中加硫酸钠晶体 |
分析 酸或碱抑制水电离,含有弱离子的盐因为水解而促进水电离,所以酸、碱或含有弱离子的盐都影响水的电离,溶液中的c(H+)>c(OH-)说明最终得到的溶液呈酸性,以此解答该题.
解答 解:A.向水中投入一小块金属钠,Na和水反应生成NaOH,NaOH抑制水电离,但溶液呈碱性,故A错误;
B.二氧化硫和水反应生成亚硫酸,溶液呈酸性,抑制水的电离,故B正确;
C.将水煮沸,温度升高促进水电离,但水中c(H+)=c(OH-),溶液呈中性,故C错误;
D.向水中加入硫酸钠,硫酸钠是强酸强碱盐,不影响水的电离,溶液仍然呈中性,故D错误;
故选B.
点评 本题考查水电离的影响因素及溶液酸碱性判断,为高频考点,侧重于学生的分析能力的考查,明确水的电离特点确定影响水电离的物质,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
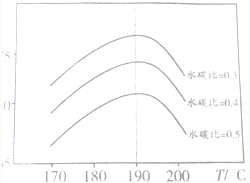 CO2和CH4均为温室气体,研究它们具有重要的意义.
CO2和CH4均为温室气体,研究它们具有重要的意义.| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 65 | 80 | 100 |
| 总压强p/100kPa | 9.53 | 7.85 | 6.37 | 5.78 | 5.24 | 4.93 | 4.67 | 4.45 | 4.45 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内每减少1mol A2,同时生成2mol AB3 | |
| B. | 容器内每减少1mol A2,同时消耗3mol B2 | |
| C. | 容器内每减少1mol A2,同时消耗1mol B2 | |
| D. | 容器内每减少1mol A2,同时生成3mol B2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后得到NH3分子数为NA | |
| B. | 一定条件下,2.3g的Na完全与O2反应生成3.5g产物时失去的电子数为0.1NA | |
| C. | 1.0L的0.1 mol•L-1Na2CO3溶液中含有的CO32-离子数为0.1NA | |
| D. | 标准状况下,11.2L的CCl4中含有的CCl4分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铜和稀盐酸 | B. | Ba(OH)2溶液滴入稀硫酸中 | ||
| C. | 澄清的石灰水和稀硝酸反应 | D. | 醋酸和氢氧化钠反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为94 | B. | 中子数为144 | C. | 质子数为238 | D. | 电子数为144 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱、氧气、碘酒 | B. | 小苏打、石灰水、二氧化硫 | ||
| C. | 干冰、铁、氯化氢 | D. | 空气、氮气、胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①②③ | D. | ③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com