
 ,
, ;
;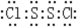 ,
,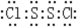 .
.


科目:高中化学 来源: 题型:
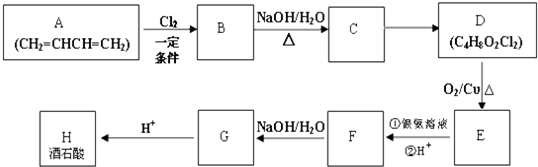

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
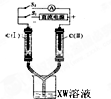 X、Y、M、Z、W为原子序数依次增大的五种短周期元素,其中X元素原子的核外电子总数等于其电子层数,Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水.
X、Y、M、Z、W为原子序数依次增大的五种短周期元素,其中X元素原子的核外电子总数等于其电子层数,Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60s内反应速率为v(X)=0.05 mol/(L?s),X的转化率为80% | ||
| B、其它条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小 | ||
| C、其它条件不变,若升高温度,X的体积分数增大,则该反应的△H>0 | ||
D、其它条件不变,将容器体积变为4L,Z的平衡浓度变为原来的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤 | 加入的试剂 | 作用 |
| 1 | ||
| 2 | ||
| 3 | ||
| … | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用溴水鉴别苯、乙醇、己烯、四氯化碳 |
| B、加浓溴水,后过滤除去苯中少量苯酚 |
| C、苯、溴水、铁粉混合制成溴苯 |
| D、可用分液漏斗分离溴乙烷和甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、ClO-、SO42-、HCOO- |
| B、Na+、K+、Cl-、NO3- |
| C、NH4+、Al3+、NO3-、Cl- |
| D、Fe2+、Cu2+、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com