
| A. | BaCl2═Ba2++2Cl- | B. | Fe2(SO4)3═Fe23++(SO4)32- | ||
| C. | HNO3═H++NO3- | D. | Ba(OH)2═Ba2++2OH- |
分析 A.氯化钡为强电解质,完全电离出钡离子、氯离子;
B.硫酸铁为强电解质,属于盐,完全电离出铁离子和硫酸根离子,铁离子、硫酸根离子角标转化为化学计量数;
C.硝酸为一元强酸,完全电离出氢离子、硝酸根离子;
D.氢氧化钡为二元强碱,完全电离出钡离子、氢氧根离子.
解答 解:A.氯化钡为强电解质,完全电离,电离方程式为:BaCl2═Ba2++2Cl-,故A正确;
B.硫酸铁为强电解质,属于盐,完全电离,电离方程式为:Fe2(SO4)3═2Fe3++3SO42-,故B错误;
C.硝酸为一元强酸,完全电离,电离方程式为:HNO3═H++NO3-,故C正确;
D.氢氧化钡为二元强碱,完全电离,电离方程式为:Ba(OH)2═Ba2++2OH-,故D正确;
故选B.
点评 本题考查电离方程式的书写,明确书写方法及弱电解质的电离书写是解答的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
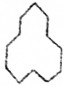 名称是环十二烷;1mol该烃完全燃烧需消耗的氧气18mol.
名称是环十二烷;1mol该烃完全燃烧需消耗的氧气18mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有大量SO32-溶液中:Na+、NH4+、SO42-、NO3- | |
| B. | 强碱性溶液中:NH4+、Ca2+、NO3-、Cl- | |
| C. | 强酸性溶液中:Cu2+、Mg2+、HCO3-、SO42- | |
| D. | 有大量Ba2+溶液中:K+、Ca2+、CO32-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释Na2CO3溶液时,C(HCO3-)、$\frac{C(O{H}^{-})}{C(C{{O}_{3}}^{2-})}$均增大 | |
| B. | 常温下,反应4Fe(OH)2(s)+2H2O(I)+O2(g)=4Fe(OH)3(s)的△H<0,△S>0 | |
| C. | 用0.1mol•L-1CH3COOH溶液滴定0.1mol•L-1 NaOH至中性时:c(CH3COO-)+c(CH3COOH)>c(Na+) | |
| D. | 向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱溶液盛装在带有橡胶塞的试剂瓶中 | |
| B. | 少量金属钠保存在煤油中 | |
| C. | 向紫色石蕊试液中加入新制氯水,石蕊试液先变红后褪色 | |
| D. | 光导纤维中所用材料为晶体硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com