
 在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A. | .原溶液的c(H+)=0.08mol/L | B. | 原溶液中n(Mg2+):n(Al3+)=10:1 | ||
| C. | x与y的差值为0.01mol | D. | 原溶液中c(Cl-)=0.066mol/L |
分析 由给出的离子在滴入NaOH溶液时发生H++OH-═H2O,Mg2+、Al3+结合OH-生成沉淀,NH4+与OH-反应,氢氧化铝与OH-反应而溶解,并结合图象可知,0~4mL时发生酸碱中和,4mL~30mL发生Mg2+、Al3+结合OH-生成沉淀的反应,30mL~33mL发生NH4+与OH-反应,33mL~35mL发生氢氧化铝的溶解反应,然后利用离子反应方程式来计算解答.
解答 解:在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入4mol•L-1的NaOH溶液,加入4mLNaOH溶液时没有沉淀生成,说明H+先和NaOH反应,则溶液中含有H+,c(H+)=$\frac{0.004L×4mol/L}{0.2L}$=0.08mol/L,继续滴加NaOH溶液,沉淀的量逐渐增大,30mLNaOH溶液后,继续滴加NaOH溶液,沉淀的物质的量不变,则溶液中含有NH4+,则c(NH4+)=$\frac{(0.033-0.03)×4mol/L}{0.2L}$=0.06mol/L,继续滴加NaOH,沉淀溶解,35mLNaOH后,沉淀不溶解,说明溶液中含有Mg2+、Al3+,根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O知,生成氢氧化铝沉淀和生成偏铝酸根离子需要氢氧化钠体积之比为3:1,则生成氢氧化铝沉淀需要NaOH体积=(35-33)mL×3=6mL,则生成氢氧化镁需要NaOH体积=(30-4mL)-6mL=20mL,
则c(Mg2+)=$\frac{0.02L×4mol/L×\frac{1}{2}}{0.2L}$=0.2mol/L,c(Al3+)=$\frac{0.006L×4mol/L×\frac{1}{3}}{0.2L}$=0.04mol/L,
溶液中存在电荷守恒,根据电荷守恒得3c(Al3+)+2c(Mg2+)+C(NH4+)+c(H+)=c(Cl-)=[3×0.04+2×0.2+0.06+0.08]mol/L=0.66mol/L,
A.由分析可知,原溶液的c(H+)=0.08mol/L,故A正确;
B.原溶液中n(Mg2+):n(Al3+)=0.2:0.04=5:1,故B错误;
C.x为Al(OH)3、Mg(OH)2的物质的量,y为Mg(OH)2的物质的量,二者的差为Al(OH)3的物质的量=0.04mol/L×0.2L=0.008mol,故C错误;
D.由分析可知,原溶液中c(Cl-)=0.66mol/L,故D错误;
故选A.
点评 本题考查物质之间的反应,明确离子反应先后顺序是解本题关键,知道铝离子转化为氢氧化铝沉淀、偏铝酸钠时消耗NaOH的体积之比,结合电荷守恒解答,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
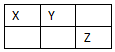 X、Y、Z、W是元素周期表前四周期元素,X、Y、Z是短周期元素,它们在周期表中的位置关系如图所示,其中Y原子的最外层电子数是电子层数的3倍.W的原子总数是Z的2倍.下列说法不正确的是( )
X、Y、Z、W是元素周期表前四周期元素,X、Y、Z是短周期元素,它们在周期表中的位置关系如图所示,其中Y原子的最外层电子数是电子层数的3倍.W的原子总数是Z的2倍.下列说法不正确的是( )| A. | W位于元素周期表第四周期ⅥA族 | |
| B. | X、W、Z的最高正化合价依次升高 | |
| C. | X、Y、Z三种元素都能与氢形成18电子化合物 | |
| D. | 简单离子半径:W>Y>X>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
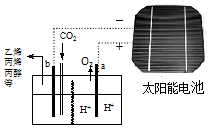 以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示. 下列说法不正确的是( )
以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示. 下列说法不正确的是( )| A. | 该装置中能量转化形式至少有两种 | |
| B. | 点解完成后溶液的C(H+)略增大 | |
| C. | 如生成的氧气在标准状况下的体积为22.4L,则透向a极迁移的H+数目为4NA | |
| D. | 如生成乙烯,则b极的反应为:2CO2+12e-+12H+=C2H4+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al:1s22s22p63s2 | B. | O2-:1s22s22p6 | ||
| C. | Na+:1s22s22p63s1 | D. | Si:1s22s22p63s23p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物理 | B. | 化学 | C. | 地理 | D. | 生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
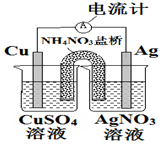
| A. | 盐桥中的NH4+离子向左侧烧杯移动 | |
| B. | 铜电极上发生的反应为Cu-2e-═Cu2+ | |
| C. | 外电路中的电子是从银电极流向铜电极 | |
| D. | 该装置能将电能转化为化学能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com