
| 试管 | 0.01mol/L KMnO4 | 0.1mol/L H2C2O4 | 0.1mol/L H2SO4 | MnSO4固体 |
| 甲 | 4mL | x mL | 1mL | 无 |
| 乙 | y mL | 2mL | 1mL | 有 |
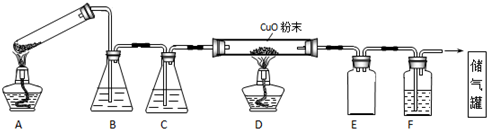
分析 (1)给试管中的固体加热时,试管口应该稍稍向下倾斜;根据图示装置及实验目的可知:B为澄清石灰水,目的是除去混合气体中二氧化碳,D为浓硫酸,目的是干燥CO气体;D中氧化铜与一氧化碳反应制取铜;E为安全瓶,起到防止倒吸的作用;F为澄清石灰水,除去二氧化碳气体,最后收集CO气体;
(2)纯度不足时一氧化碳气体会发生爆炸,所以先点燃A处酒精灯,用生成的CO将装置中空气排净,然后再点燃D处的酒精灯;熄灭酒精灯时,应该先熄灭D处酒精灯,然后再熄灭A处酒精灯;
(3)①根据配制一定物质的量浓度的溶液的方法判断需要的仪器;
②根据反应原理及高锰酸钾的物质的量计算出该草酸晶体中含有草酸的物质的量、质量,再计算出结晶水的物质的量,最后计算出x;
(4)探究催化剂催化剂对反应速率的影响时,其它条件必须完全相同,据此判断x、y值;使用催化剂后反应速率加快,溶液褪色时间减小.
解答 解:(1)反应中有水生成,容易导致试管炸裂,所以A装置中试管口应向下倾斜;B为澄清石灰水,目的是除去混合气体中二氧化碳,D为浓硫酸,目的是干燥CO气体;D中CuO与CO反应制取Cu;E为安全瓶,起到防止倒吸的作用;F为澄清石灰水,除去二氧化碳气体,
故答案为:试管口应向下倾斜;浓硫酸;安全瓶(或防倒吸);
(2)CO气体的纯度不足时会发生爆炸现象,所以应该先点燃A处酒精灯,用生成的CO将装置中空气排净,然后再点燃D处的酒精灯;熄灭酒精灯时恰好相反,先熄灭D处酒精灯,然后再熄灭A处酒精灯,所以正确的操作方法为:①③④②;避免发生爆炸现象,所以点燃D处酒精灯前必须要进行检验CO纯度,
故答案为:①③④②;验纯;
(3)①配制草酸溶液除需要玻璃棒、烧杯,配制100mL溶液需要选用100mL容量瓶,定容时还需要胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
②16mL 0.0500mol/L高锰酸钾溶液中含有高锰酸钾的物质的量为:0.0500mol/L×0.016L=0.0008mol,100mL该醋酸溶液能够消耗高锰酸钾的物质的量为:0.0008mol×$\frac{100mL}{20mL}$=0.004mol,根据反应2MnO4-+5H2C2O4+6H+=10CO2+2Mn2++8H2O可知1.17g样品中含有草酸的物质的量为:0.004mol×$\frac{5}{2}$=0.01mol,草酸的质量为:90g/mol×0.01mol=0.9g,含有结晶水的物质的量为:$\frac{1.17g-0.9g}{18g/mol}$=0.015mol,则该草酸晶体中x=$\frac{0.015mol}{0.01mol}$=1.5,
故答案为:1.5;
(4)为探究催化剂对化学反应速率的影响,除了有催化剂和无催化剂以外,其它条件必须完全相同,则x=2、y=4;催化剂能够加快反应速率,则加入MnSO4固体的试管中溶液褪色速率比未加的快,
故答案为:2;4;加入MnSO4固体的试管中溶液褪色速率比未加的快.
点评 本题考查了探究物质组成、称量物质含量的方法,题目难度中等,熟练掌握化学实验基本操作方法为解答关键,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验、化学计算能力,是一道质量较好的题目.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 弱电解质的相对强弱--电离常数的大小 | |
| C. | 分子间作用力的大小--分子稳定性的高低 | |
| D. | 物质内部储存的能量--化学反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验I中得到的溶液滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5% | B. | 25% | C. | 17% | D. | 33% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据物质性质完成下列题型.
根据物质性质完成下列题型.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融状态或溶于水能导电的物质叫电解质 | |
| B. | 电解质在通电时发生电离 | |
| C. | 熔融的KOH导电,所以KOH是电解质 | |
| D. | NaCl晶体不导电,所以NaCl不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于氢氧化钠溶液:Al+2OH-═2AlO2-+H2↑ | |
| B. | NaHCO3溶液与硫酸氢钠溶液混合:HCO3-+H+═H2O+CO2↑ | |
| C. | 过氧化钠与水反应:Na2O2+2H2O═2Na++2OH-+O2↑ | |
| D. | Ca(OH)2溶液中通入过量CO2:Ca2++2OH-+CO2═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 工业上制取漂白粉:向澄清石灰水中通入足量的Cl2 | |
| B. | 验证醋酸是弱电解质:常温下测定0.1 mol•L-1醋酸或醋酸钠溶液的pH | |
| C. | 探究FeCl3和KI溶液反应限度:向5mL0.1 mol•L-1KI溶液中加入0.1 mol•L-1 FeCl3溶液1mL,振荡,加苯萃取后,向水层中加入5滴KSCN溶液,观察实验现象 | |
| D. | 检验蔗糖水解生成的葡萄糖:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2=2O3有单质参加,属于氧化还原反应 | |
| B. | 人造纤维,合成纤维和光导纤维都是有机高分子化合物 | |
| C. | 加热能杀死流感病毒是因为病毒的蛋白质受热变性 | |
| D. | 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com