
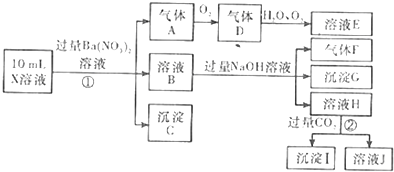
分析 在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定的是否含有的离子Fe3+和Cl-,以此解答(1)(2)两小题,再结合电荷守恒解答(3);
解答 解:(1)在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,检验氯离子的方法是:取少量B溶液放在试管中,加入几滴AgNO3溶液,无白色沉淀说明无Cl-,故一定含有的是Al3+、NH4+、Fe2+、SO42-,不能确定的是Fe3+、Cl-,确定Fe3+不存在,方法是向取少量溶液与试管中,加入KSCN溶液,若溶液不变红色,则说明溶液中无Fe3+;
故答案为:Al3+、NH4+、Fe2+、SO42-;
(2)①Fe2+离子被氧化为Fe3+离子,反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,②H为NaOH和NaAlO2混合物,通入过量二氧化碳后分别发生的反应为:CO2+OH-=HCO3-,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故生成沉淀的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-; 故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知亚铁离子为0.03mol,根据溶液电中性可知:2n(Fe2+)+3n(Al3+)+n(NH4+)=2n(SO42-),n(SO42-)=$\frac{2×0.03mol+3×0.01mol+0.01mol+0.04mol}{2}$=0.07mol,当沉淀C物质的量>0.07mol时一定含有Fe3+离子,同时含有Cl-离子,故答案为:A;因为肯定存在的离子构成的溶液正负电荷已守恒.又不能确定溶液中是否含有Fe3+,若含有Fe3+离子,同时含有Cl-离子.
点评 本题为考查离子组推断题,题目具有一定难度,本题解答时一定要紧扣反应现象,推断各离子存在的可能性,本题易错点为(3)题,注意溶液电中性的利用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向样品溶液中逐渐加入少量锌粉,开始时未见产生气泡,样品溶液中一定不存在稀硫酸 | |
| B. | 向样品溶液中加入一定质量的铁粉后,充分反应后,有残余固体且质量比原加入的铁粉多,样品溶液中一定含有硫酸铜 | |
| C. | 向样品溶液中加入铜片,铜片溶解,溶液中一定含有硫酸铁 | |
| D. | 向样品溶液中逐滴滴入氢氧化钠,当滴入一定量后才观察到有浑浊现象,则样品溶液中一定含有稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| B. | 药皂中加入少量苯酚,可以起到杀菌消毒的作用 | |
| C. | 石油是混合物,其分馏产品汽油为纯净物 | |
| D. | 金属铝需经过特别处理才具有抗腐蚀能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
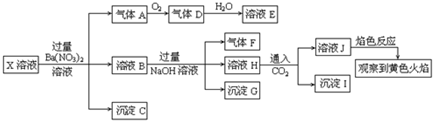
| A. | X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- | |
| B. | 气体F经催化氧化可直接生成气体D | |
| C. | 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I可能有Al(OH )3 | |
| D. | X中不能确定的离子有Na+、K+和C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
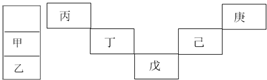
| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,甲和乙的单质均能与水剧烈反应 | |
| D. | 丁的最高价氧化物可广泛可于太阳能电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 | |
| B. | 加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 | |
| C. | 加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 | |
| D. | 加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某些金属的单质和化合物在火焰上灼烧时都能显现特殊的颜色,因此焰色反应是元素的性质 | |
| B. | 钾的焰色为紫色,必须通过蓝色钴玻璃才能观察到 | |
| C. | 焰色反应是物理过程,但也可能伴随着化学变化 | |
| D. | 烟花能显现出五颜六色,与烟花中含有某些金属元素的盐类有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com