
[14分]实验室制备苯乙酮的化学方程式为:
制备过程中还有
 等副反应。
等副反应。
主要实验装置和步骤如下:
(I)合成:在三颈瓶中加入20 g无水AlCl3和30 mL无水苯。为避免反应液升温过快,边搅拌边慢慢滴加6 mL乙酸酐和10 mL无水苯的混合液,控制滴加速率,使反应液缓缓回流。滴加完毕后加热回流1小时。
(Ⅱ)分离与提纯:
①边搅拌边慢慢滴加一定量浓盐酸与冰水混合液,分离得到有机层
②水层用苯萃取,分液
③将①②所得有机层合并,洗涤、干燥、蒸去苯,得到苯乙酮粗产品
④蒸馏粗产品得到苯乙酮。回答下列问题:
(1)仪器a的名称:____________;装置b的作用:________________________________。
(2)合成过程中要求无水操作,理由是____________________________________________。
(3)若将乙酸酐和苯的混合液一次性倒入三颈瓶,可能导致_________________。
| A.反应太剧烈 | B.液体太多搅不动 | C.反应变缓慢 | D.副产物增多 |

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:填空题
某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体又可用于验证物质的性质。请回答下列问题:
(1)利用装置Ⅰ制取气体,生成气体的反应应具备的条件是 。
(2)利用装置Ⅰ、Ⅱ制取气体(K2关闭,K1打开)。甲同学认为:利用装置Ⅱ可以收集H2、NH3等气体,但不能收集O2和NO等气体,其理由是:
_______________________________________________________________________;
乙同学认为:对装置Ⅱ做简易改进(不改变仪器装置),也可收集O2和NO等气体,但不能收集NO2气体,改进的方法是 ;不能收集NO2气体的原因是(用化学方程式表示) ;
(3)利用装置Ⅰ、Ⅲ 验证物质的性质(K2打开,K1关闭)。如要设计实验证明氧化性
KMnO4>Cl2>Br2,则可在A 中加浓盐酸,B中加 ,C中加 ,观察到C中的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)硫酸亚铁铵又称莫尔盐,是浅绿色晶体。它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂。某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度。
已知:①
②莫尔盐在乙醇溶剂中难溶。
Ⅰ.莫尔盐的制取
试分析:
(1)步骤2中加热方式 (填“直接加热”﹑“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是 。
(2)步骤3中包含的实验操作名称 。
(3)产品莫尔盐最后用 洗涤(填字母编号)。
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4?FeSO4?6H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500 mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00 mL硫酸亚铁铵溶液用0.1000 mol·L-1的酸性KMnO4溶液分三次进行滴定。
(乙)方案二:取20.00 mL硫酸亚铁铵溶液进行如下实验。
(1)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为
,验证推测的方法为: 。
(丙)方案三:(通过NH4+测定)实验设计图如下所示。取20.00 mL硫酸亚铁铵溶液进行该实验。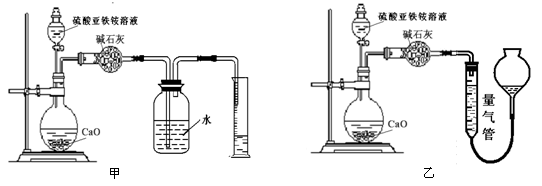
(2)①装置 (填“甲”或“乙”)较为合理,判断理由是 。量气管中最佳试剂是 (填字母编号。如选“乙”则填此空,如选“甲”此空可不填)。
a.水 b.饱和NaHCO3溶液 c.CCl4
②若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
【选修2-化学与技术】(15分)
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下: 
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是________(填化学式),若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式______________________。
(2)在操作①中保持pH=8的目的是_________________________________。
(3)沉淀Ⅰ的主要成分是___________________________________________。
(4)操作③中加热、煮沸的目的是___________。此步骤操作的理论依据是_______________。
(5)操作④保持pH=2的目的是_______。此步骤操作中所用的主要仪器是_____ ______。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)实验室模拟合成氨和氨催化氧化的流程如下:
(1)已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气,该反应中只有氮元素发生变价,写出该反应的化学方程式 。从下图中选择制取氮气的合适装置 。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 。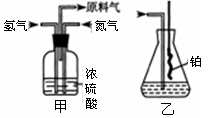
(3)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 。
(4)反应结束后锥形瓶内的溶液中含有H+、OH-、 离子。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如下: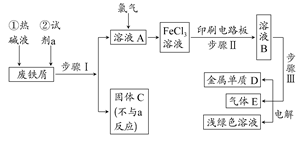
(1)试剂a应选用 (填写名称);
(2)步骤I用到的主要玻璃仪器有漏斗、 (填写仪器名称);
(3)写出步骤Ⅱ中主要反应的化学方程式: ;
(4)实验室制取气体E的离子方程式是 ,欲对气体E进行干燥和吸收,需选用下列装置中的 (填写序号);
(5)如何用化学方法检验气体E? 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置(部分夹持装置已略去):
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)试从原子结构角度解释氯的氧化性大于硫的原因 。
(4)D中干燥管中出现的现象及化学方程式 。
(5)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请画出其装置图 (并注明盛装试剂)。
(6)还有什么方法能证明氧化性Cl2>S,用一种相关事实说明 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。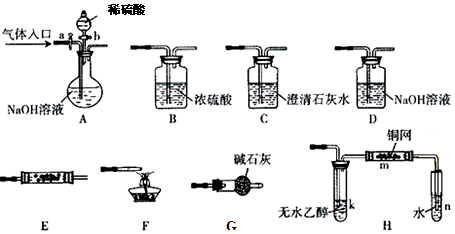
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产物的现象是 。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应 ,活塞b应 ,需要加热的仪器装置有 (填代号),m中反应的化学方程式为: 。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,按A→G→E→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有 。
②实验中观察到E内有红棕色气体出现,证明氨气具有 性。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗产品并精制的流程: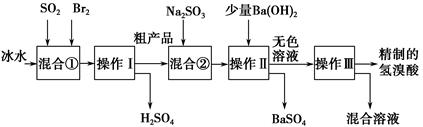
根据上述流程回答下列问题:
(1)混合①中发生反应的离子方程式为________________________________。
(2)混合①中使用冰水的目的是_______________________________________。
(3)操作Ⅲ一般适用于分离________混合物。(填序号)
a.固体和液体 b.固体和固体
c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是____________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为其中含有Fe3+,则用于证明该假设所用的试剂为________,若假设成立可观察到的现象为__________________;乙同学假设工业氢溴酸呈淡黄色是因为其中含有________________,其用于证明该假设所用的试剂为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com