

 =0.01mol,
=0.01mol, =0.005mol.
=0.005mol.

科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2010年江西省九江市高三第二次模拟考试(理综)化学部分 题型:选择题
2009年4月23日下午,在青岛解放军码头举行了庆祝中国人民解放军60周年仪式。下列与海军舰艇有关的说法中不正确的是 ( )
A.涂在舰艇上的隐身纳米涂料中的空心微粒的直径约是4mm左右,该空心微粒与水组成的混合物可发生丁达尔现象
B.舰艇在海水中比在江河中更容易腐蚀,是因为海水中含氧量大
C.参加阅兵的舰艇中使用的生氧剂是过氧化钠,可实现潜艇舱内的空气交换
D.舰艇内部通信采用的光纤(SiO2)和机舱发动机采用的氧化铝陶瓷都属于新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:
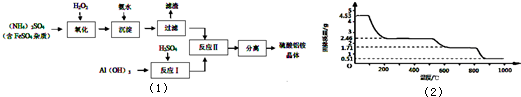
纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到。[已知:硫酸铝铵晶体的化学式为(NH4)Al (SO4)n·12H2O]
制备硫酸铝铵晶体的实验流程如下:
 |
(1)检验上述流程中“过滤”后杂质是否除尽的实验方法是 。
(2)上述流程中,“分离”所包含的操作依次为: 、 、过滤、洗涤、干燥。
(3)硫酸铝铵水溶液呈酸性的原因是 (用离子方程式表示)。
(4)写出上述“反应Ⅱ”中获得硫酸铝铵晶体的化学方程式 。
(5)向硫酸铝铵溶液中加入氢氧化钡溶液至Al3+刚好沉淀完全,写出反应的离子方程式 。
(6)取4.53 g硫酸铝铵晶体加热分解,加热过程中,固体质量随时间的变化如下图所示:

写出400℃时剩余固体成分的化学式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com