
分析 (1)煤可燃烧,燃烧时产生大量二氧化硫和烟尘,且燃烧效率较低,可通过洁净煤技术,如煤的气化和液化以及烟气脱硫,提高煤燃烧的热利用率;
(2)多孔金属具有较大的接触面积.
解答 解:(1)煤可燃烧,燃烧时产生大量二氧化硫和烟尘,且燃烧效率较低,可通过洁净煤技术,如煤的气化和液化以及烟气脱硫,提高煤燃烧的热利用率,如用煤直接做燃料,可导致环境污染,造成较大浪费,ACD正确,
故答案为:ACD;
(2)物质气态时燃烧时更充分,故煤油燃料雾化器能将煤油由液态雾化为气态,燃烧更充分,故答案为:增大接触面积,使燃料燃烧更充分.
点评 本题考查环境污染问题,能源、信息、材料、环境是当今世界四大首要问题,在能源危机日趋严重的今天,它既是社会热点,也是化学考查的热点,主要侧重能源的分类、能源使用对环境的影响、新能源开发的技术和前景等.


科目:高中化学 来源: 题型:实验题
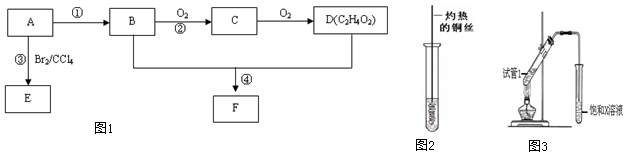
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
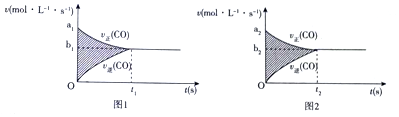
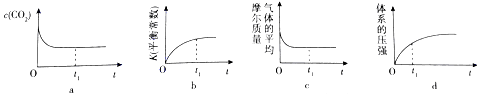
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

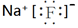 .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
在含有酚酞的0.1 mol / L氨水中加入少量的 NH4Cl晶体,则溶液颜色( )
A.变蓝色 B.变深 C.变浅 D.不变
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙苯催化脱氢生产苯乙烯的反应:
乙苯催化脱氢生产苯乙烯的反应: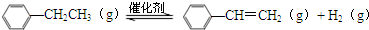
化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com