
【题目】可逆反应m A(s)+n B(g)e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( ) 
A.达平衡后,若升温,则K减小
B.达平衡后,加入催化剂C%增大
C.化学方程式中n>e+f
D.达平衡后,若增加A的量,B的转化率增大
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】某有机物含有C、H、O三种元素,其质谱如图所示.将4.3g该有机物在O2中充分燃烧,使生成物依次通过足量浓硫酸和碱石灰,浓硫酸增重2.7g,碱石灰增重8.8g,则: 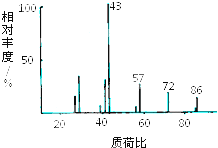
(1)该有机物的摩尔质量为 .
(2)该有机物的分子式为 .
(3)1mol该有机物与足量的金属钠反应产生1mol氢气,核磁共振氢谱有两个峰,且面积比为2:1,请写出其结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、实验室可以用KMnO4固体和浓盐酸反应制取少量Cl2,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O回答下列问题:
(1)该反应中被氧化的元素是__________.
(2)氧化性:KMnO4__________Cl2(填“>”、“<”或“=”)
(3)该反应中氧化剂和氧化产物的物质的量之比为__________.
(4)用双线桥法表示该反应中电子转移的方向和数目:_________
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
(5)每生成标准状况下2.24L Cl2,反应中转移电子的物质的量为__________.
Ⅱ、实验室常用以下方法制取氯气:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O请你根据所学知识回答下列问题:
MnCl2+Cl2↑+2H2O请你根据所学知识回答下列问题:
(1)把氯气通入紫色石蕊试液中,可以观察到的现象是:________________,请你解释其中的原因 __________________________________________________
(2)为保证实验安全,常用NaOH溶液吸收多余的氯气。写出反应的化学方程式__________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].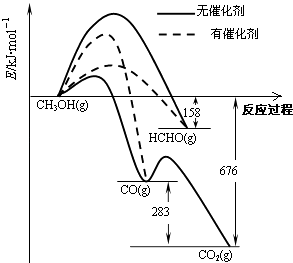
(1)①在有催化剂作用下,CH3OH与O2反应主要生成(填“CO、CO2”或“HCHO”).2HCHO(g)+O2(g)═2CO(g)+2H2O(g)△H= .
②甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性.用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: .
(2)已知:CO(g)+2H2(g)CH3OH(g)△H=﹣a kJmol﹣1 .
①经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4molL﹣1、c(H2)=0.4molL﹣1、c(CH3OH)=0.8molL﹣1 , 则此时v正v逆(填“>”、“<”或“=”).
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则0~15min,用H2表示的平均反应速率为 , 达到平衡时CO的转化率为 .
(3)利用钠碱循环法可除去SO2 , 消除SO2对环境的污染.吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①根据上表判断NaHSO3溶液显性.
②在NaHSO3溶液中离子浓度关系正确的是 (填字母).
a.c(Na+)=2c(SO32﹣)+c(HSO3﹣)
b.c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣)
c.c(H2SO3)+c(H+)=c(SO32﹣)+(OH﹣)
d.c(Na+)+c(H+)=c(SO32﹣)+c(HSO3﹣)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡. I、已知H2A在水中存在以下平衡:H2AH++HA﹣ , HA﹣H++A2﹣ .
(1)NaHA溶液的pH(填大于、小于或等于) Na2A溶液的pH.
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性.此时该混合溶液中下列关系中,一定正确的是 . a.c(H+)c(OH﹣)=1×10﹣14 b.c(Na+)+c(K+)=c(HA﹣)+2c(A2﹣)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2﹣(aq)△H>0. ①降低温度时,Ksp(填“增大”、“减小”或“不变”).
②滴加少量浓盐酸,c(Ca2+)(填“增大”、“减小”或“不变”).
(4)II、含有Cr2O72﹣的废水毒性较大,某工厂废水中含5.00×10﹣3 molL﹣1的Cr2O72﹣ . 为使废水能达标排放,作如下处理: Cr2O72﹣ ![]() Cr3+、Fe3+
Cr3+、Fe3+ ![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
①该废水中加入绿矾(FeSO47H2O)和H+ , 发生反应的离子方程式为: .
②欲使10L该废水中的Cr2O72﹣完全转化为Cr3+ , 理论上需要加入g FeSO47H2O.
③若处理后的废水中残留的c(Fe3+)=2×10﹣13molL﹣1 , 则残留的Cr3+的浓度为 . (已知:Ksp[Fe(OH)3]=4.0×10﹣38 Ksp[Cr(OH)3]=6.0×10﹣31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E,F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下: ①A的周期序数等于其主族序数;
②B、D原子的L层中都有两个未成对电子;
③E元素原子最外层电子排布式为(n+1)Sn(n+1)Pn﹣1;
④F原子有四个能层,K、L、M全充满,最外层只有一个电子.
试回答下列问题:
(1)基态E原子中,电子占据的最高能层符号为 , F的价层电子排布式为 .
(2)B,C,D的电负性由大到小的顺序为(用元素符号填写),C与A形成的分子CA3的VSEPR模型为 .
(3)B和D分别与A形成的化合物的稳定性:BA4小于A2D,原因是 .
(4)以E,F的单质为电极,组成如图1所示的装置,E极的电极反应式为 . 
(5)向盛有F的硫酸盐FSO4的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色溶液,再向深蓝色透明溶液中加入乙醇,析出深蓝色晶体.蓝色沉淀溶解的离子方程式为 .
(6)F的晶胞结构(面心立方)如图2所示:已知两个最近的F的距离为acm,F的密度为g/cm3(阿伏伽德罗常数用NA表示,F的相对原子质量用M表示) 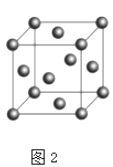
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 同温同压下,相同体积的物质,它们的物质的量必相等
B. 任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
C. 1L一氧化碳气体一定比1L氧气的质量小
D. 等体积、等物质的量浓度的强酸中所含的H+数一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B为气体单质,其中A为黄绿色气体,B为无色气体; C为化合物,其水溶液的pH小于7;D为金属单质,它们之间有下列转化关系:

(1)试写出A、B、C、D的化学式: A_________;B_________;C___________;D_________。
(2)写出C的水溶液与D反应的离子方程式:__________;F+D反应的离子方程式:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com