
| 1000ρω |
| M |
| n |
| V |
| 1000ρω |
| M |
| 1000×98%×1.84g/cm3 |
| 98g/mol |


科目:高中化学 来源: 题型:
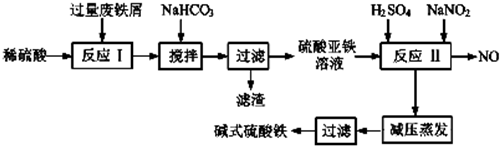
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | A1(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA的物质的量浓度(mol?L-1) | NaOH的物质的量浓度(mol?L-1) | 混合后溶 液的pH |
| 甲 | 0.1 | 0.1 | pH=7 |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MnO2+浓HCl |
| B、KMnO4+HCl |
| C、KClO3+HCl |
| D、电解盐酸(惰性电极) |
查看答案和解析>>
科目:高中化学 来源: 题型:
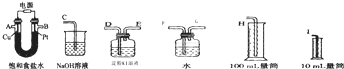
查看答案和解析>>
科目:高中化学 来源: 题型:
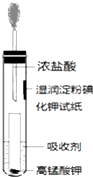 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com