
已知某温度下CH3COOH和NH3•H2O的电离常数相等,现向1mL浓度为0.5mol•L﹣1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
|
| A. | 水的电离程度始终增大 |
|
| B. | 当加入氨水的体积为1 mL时,c(NH4+)=c(CH3COO﹣) |
|
| C. |
|
|
| D. | c(CH3COOH)与c(CH3COO﹣)之和始终保持不变 |
| 酸碱混合时的定性判断及有关ph的计算.. | |
| 专题: | 电离平衡与溶液的pH专题. |
| 分析: | A.开始时,溶液的酸性逐渐减弱,水的电离程度逐渐增大,当氨水过量后,溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小; B.CH3COOH和NH3•H2O的电离常数相等,氨水与醋酸的浓度、体积相等时,溶液显示中性,根据电荷守恒可知c(NH4+)=c(CH3COO﹣); C.根据一水合氨的电离平衡常数可知,该比值与氢氧根离子成反比,电解氨水的过程中,溶液中氢氧根离子浓度逐渐增大; D.根据物料守恒,醋酸和醋酸根离子的物质的量之和不变,但溶液体积增大,二者的浓度之和逐渐减小. |
| 解答: | 解:A.酸溶液、碱溶液抑制了水的电离,溶液显示中性前,随着氨水的加入,溶液中氢离子浓度逐渐减小,水的电离程度逐渐增大;当氨水过量后,随着溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小,所以滴加过程中,水的电离程度先增大后减小,故A错误; B.当加入氨水的体积为1mL时,醋酸和一水合氨的物质的量相等,由于二者的电离常数相等,所以溶液显示中性,c(H+)=c(OH﹣),根据电荷守恒可知:c(NH4+)=c(CH3COO﹣),故B正确; C.当向CH3COOH溶液中滴加相同浓度的氨水,开始时溶液为CH3COOH和CH3COONH4的混合物,由CH3COONH4的水解常数Kh= D.n(CH3COOH)与n(CH3COO﹣)之和为0.001mol,始终保持不变,由于溶液体积逐渐增大,所以c(CH3COOH)与c(CH3COO﹣)之和逐渐减小,故D错误; 故选B. |
| 点评: | 本题考查了酸碱混合时溶液定性判断、溶液中离子浓度大小比较,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确根据电荷守恒、物料守恒、盐的水解比较溶液中离子浓度大小的方法,试题考查了学生的分析、理解能力及灵活应用所学知识的能力. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
主链为4个碳原子的单烯烃共有4种同分异构体,则与这种单烯 烃具有相同的碳原子数、主链也为4个碳原子的某烷烃有( )。
烃具有相同的碳原子数、主链也为4个碳原子的某烷烃有( )。
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1 mol O2与Na完全反应,转移电子数一定为4NA
B.常温常压下,1.7克NH3中含有共价键的数目为NA
C.142g Na2SO4和Na2HPO4混合物中含有的阴、阳离子总数是3 NA
D.标准状况下,11.2 L SO3所含的分子数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 摩尔是用来衡量微观粒子多少的一种物理量 |
|
| B. | 在一定的温度和压强下,各种气体的摩尔体积相等 |
|
| C. | 阿伏加德罗常数的数值是0.012 kg碳所含的原子个数 |
|
| D. | 若气体摩尔体积为22.4 L•mol﹣1,则所处条件为标准状况 |
查看答案和解析>>
科目:高中化学 来源: 题型:
1.92g Cu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为( )
|
| A. | 504mL | B. | 336mL | C. | 224mL | D. | 168mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
A是化合物,B是单质,它们之间相互反应以及生成物之间的转化关系如图所示: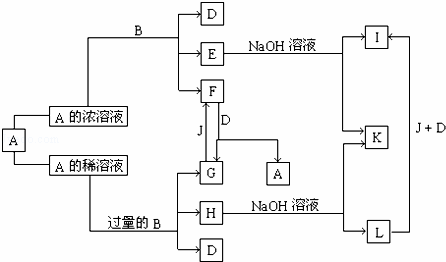
已知E溶液跟某常见有机物混合时,溶液呈紫色.请回答:
(1)B和A的浓溶液反应的条件是 ,过量B和A的稀溶液反应的化学方程式为3 .
(2)写出G和F相互转化的化学方程式:G→F .
(3)L转化成I的现象是 ; 有关的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某校高三同学高考前重做以下两个课本实
验,请你回答实验过程中的相关问题:
 (1)铝热反应实验:取磁性氧化铁粉按课本中的实验装置(如图)进
(1)铝热反应实验:取磁性氧化铁粉按课本中的实验装置(如图)进
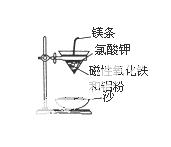 行铝热反应,将反应后所得“铁块”溶于盐酸,向反应后的溶液
行铝热反应,将反应后所得“铁块”溶于盐酸,向反应后的溶液
中滴加K SCN溶液,发现溶液变血红色。
SCN溶液,发现溶液变血红色。
①出现这种现象的原因,除了因“铁块”中可能混有没反应完的
磁性氧化铁外,还有一种可能原因是  。
。
② 若要证明反应所得“铁块”中含有金属铝,可用 (填化学式)溶液,所发生反应的离子方程式为 。
(2)化学反应速率影响因素的探究实验:
KI在经酸化的溶液中被空气氧化的反应式为:4H+ + 4I-+ O2 = 2I2 + 2H2O。该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率。已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深。
实验小组拟用0.8 mol·L-1 KI溶液、0.1 mol·L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A—C三组实验,部分实验数据如下表:
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 / mL | 出现蓝色时间 /s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
①为确保A组实验在39℃下进行,应采用的控温操作方法是 。
②A—C三组实验时,都加入了5mL水,其目的是  。
。
③B组实验中“没出现蓝色”,原因是 。
④请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标。
⑤按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结
论 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.糖类化合物都具有相同的官能团 B.酯类物质是形成水果香味的主要成分
C.油脂的皂化反应生成脂肪酸和丙醇 D.蛋白质的水解产物都含有羧基和羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
柑橘中柠檬烯的结构可表示为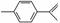 ,下列关于这种物质的说法中正确的是 ( )
,下列关于这种物质的说法中正确的是 ( )
A.与苯的结构相似,性质也相似
B.可使溴的四氯化碳溶液褪色
C.易发生取代反应,难发生加成反应
D.该物质极易溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com