
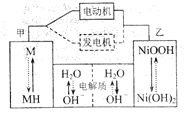
【题目】混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示:其中M为储氢合金,![]() 为吸附了氢原子的储氢合金,
为吸附了氢原子的储氢合金,![]() 溶液作电解液。关于镍氢电池,下列说法正确的是( )
溶液作电解液。关于镍氢电池,下列说法正确的是( )
A.充电时,阴极附近![]() 降低
降低
B.发电机工作时溶液中![]() 向甲移动
向甲移动
C.放电时正极反应式为:![]()
D.电极总反应式为:![]()
【答案】C
【解析】
放电过程为原电池,NiOOH转变为Ni(OH)2,镍元素化合价由+3价降到+2价,乙为正极,电极反应式为NiOOH+H2O+e-═Ni(OH)2+OH-,甲为负极,MH中氢元素化合价由0价升高到+1价,发生氧化反应与溶液中的氢氧根离子结合成水,电极反应为MH-e-+OH-═M+H2O;充电是放电的逆过程,此时甲为阴极,发生还原反应,乙为阳极,发生氧化反应。
A. 充电时,阴极发生还原反应,电极反应为M+H2O+e═MH+OH,生成氢氧根,pH增大,A错误;
B. 发电机工作时是充电过程,电解池原理,溶液中氢氧根离子向阳极移动,即乙电极迁移,B错误;
C. 正极得电子,发生还原反应,其电极反应式为NiOOH+H2O+e═Ni(OH)2+OH,C正确;
D. 放电过程的正极反应为:NiOOH+H2O+e═Ni(OH)2+OH,负极反应为:MH-e-+OH-═M+H2O,则电池总反应为:![]() ,D错误;故答案为:C。
,D错误;故答案为:C。


科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是______(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):
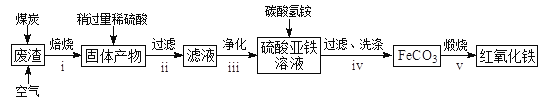
回答下列问题:
①在步骤i中产生的有毒气体可能有__________________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上使Al3+恰好沉淀完全即溶液中c(Al3+)=1×10-5mol/L,则溶液的pH为____________。
③步骤iv中,生成FeCO3的离子方程式是_________________。
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入适量氧化铜粉末会产生沉淀,写出该沉淀的化学式______________。这一过程的总反应的离子方程式______。
(4)古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物,羟基自由基的产生与溶液pH大小有关。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
(实验过程)
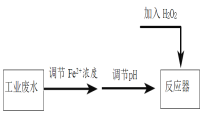
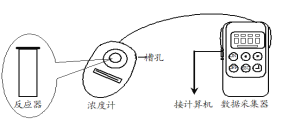
用图所示装置进行如下表所示的实验,控制p-CP的初始浓度相同,其余实验条件见下表,设计如下对比实验,最终测量的是p-CP浓度的改变量。
(实验数据)
实验编号 | H2O2溶液 | Fe2+溶液 | 蒸馏水 | pH | 温度 | ||
c/(10-3mol·L-1) | V/mL | c/(10-3mol·L-1) | V/mL | V/mL | T/K | ||
① | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 3 | 298 |
② | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 3 | 313 |
③ | 6.0 | 3.5 | 0.30 | 3.5 | x | 3 | 298 |
④ | 6.0 | 1.5 | 0.30 | 4.5 | 9 | 3 | 298 |
⑤ | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 10 | 298 |
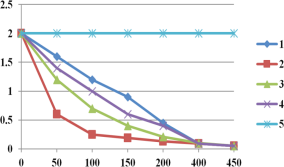
图2实验测得p-CP的浓度随时间的变化
(分析与解释)
(1)实验③中,x=________。
(2)实验①、⑤的目的是________。
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高是反而导致降解反应速率减少,从Fenton法所用试剂H2O2性质的角度分析原因_____(请用化学用语解答)。
(4)通过实验⑤可以得出结论是是pH等于10时,降解反应趋于停止,推测可能的原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于柠檬酸(如图)的性质推测的叙述错误的是
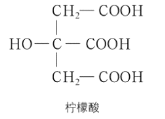
A.柠檬酸可与 NaHCO3 溶液反应生成 CO2
B.柠檬酸分子中具有羟基官能团,因此可与NaOH 溶液反应
C.家里可以用柠檬酸除水垢
D.柠檬酸分子中的两种官能团都能跟金属钠反应生成氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用。若1 mol七叶树内酯分别与浓溴水、NaOH溶液和足量氢气完全反应,则消耗的Br2 、NaOH和H2的物质的量分别为
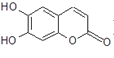
A. 1 mol Br2;2 mol NaOH;1 mol H2
B. 3 mol Br2;4 mol NaOH;1 mol H2
C. 2 mol Br2;3 mol NaOH;4 mol H2
D. 3 mol Br2;4 mol NaOH;4 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是
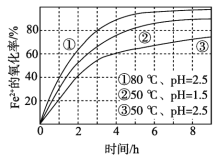
A. Fe2+的氧化率随时间延长而逐渐增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,温度越高,Fe2+氧化速率越快
D. 氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乌头酸的结构简式如图所示,下列关于乌头酸的说法错误的是
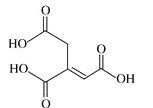
A. 分子式为 C6H6O6
B. 乌头酸既能发生水解反应,也能使酸性高锰酸钾溶液褪色
C. 乌头酸分子中所有碳原子可能共平面
D. 含 1 mol 乌头酸的溶液最多可消耗 3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A、B、C、D、E、F有以下转化关系。A是分子量为28的气体烯烃,其产量是衡量一个国家石油化工生产水平的标志;D是食醋的主要成分,E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍,F是一种高分子化合物。结合如图关系回答问题:
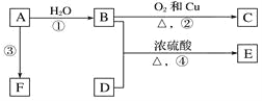
(1)写出B、D中官能团的名称:B_____、D_____。
(2)写出下列反应的化学方程式:
①_____;该反应类型是_____。
②_____;该反应类型是_____。
④_____。
(3)实验室用如图的装置制备E,试管A中浓硫酸的作用是______;B中的试剂是______;关于该实验下列说法不正确的是______;
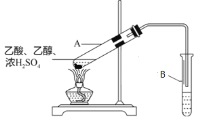
①加热试管A不仅可以加快反应速率,还可以蒸出E,促进反应进行
②从试管A中蒸出来的物质只有产物E
③振荡后B中油状液体层变薄主要是产物E溶解到试剂B中
④B中导管应该插入到液面以下
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com