
钴周期表第四周期第Ⅷ族元素,其化合物用途广泛,如:LiCoO2做锂电池的正极材料;草酸钴可用于指示剂和催化剂制备。
Ⅰ.(1)LiCoO2中钴元素的化合价为_______
(2)工业上将废锂电池的正极材料与过氧化氢溶液,稀硫酸混合加热,可得到CoSO4回收,反应的化学方程式为:______________;可用盐酸代替H2SO4和H2O2的混合液,但缺点是____________
Ⅱ.利用一种含钴矿石[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(3)浸出液中加NaClO3的目的是:______________.
(4)请用平衡移动原理说明加Na2CO3调pH至5.2所得沉淀的原因:____________
(5)滤液Ⅱ中加入萃取剂的作用是___________
(6)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=___________。
科目:高中化学 来源:2016-2017学年湖南省长沙市高二上学期期末考试化学试卷(解析版) 题型:填空题
H2SO4是工业上常用的酸,NH4Al(SO4)2是一种食品加工业中常用的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_____________(用离子方程式说明)。
(2)20℃时,均为0.1mol L-1的几种电解质溶液的pH 随温度变化的曲线如图1 所示。
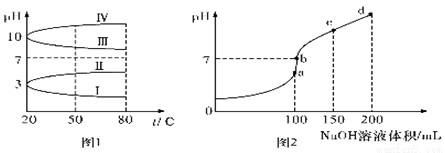
① 其中符合0.1mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是_______(填罗马数字)。
② 20℃ 时,0.1mol·L-1NH4Al(SO4)2溶液中,2c(SO42-)-c(NH4+)-3c(Al3+)=____mol·L-1(填具体数字计算式,不必化简)
(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol L-1NaOH溶液,溶液pH 与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d 四个点,水的电离程度最大的是__________点,在b点,溶液中各离子浓度由大到小的排列顺序是___________________。
(4)t℃ 时,pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省台州市高一上学期期末质量评估考试化学试卷(解析版) 题型:选择题
某铁矿石(若只含铁的氧化物和SiO2)取36g溶于过量的稀盐酸中,过滤、洗涤、干燥后得5.6g不溶物,向得到的滤液中加入足量的NaOH溶于,过滤、洗涤后将沉淀灼烧,得32g红棕色固体。根据题意下列结论不正确的是
A. 由铁矿石转化为红棕色固体的过程中发生了氧化还原反应
B. 溶于盐酸后得到的滤液中n(Fe2+):n(Fe3+)=1:1
C. 铁矿石中的铁的氧化物的化学式一定是Fe3O4
D. 若稀盐酸为3.0mol·L-1 400ml,反应前后体积变化忽略不计,则滤液中剩余H+的物质的量浓度是0.5mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省台州市高一上学期期末质量评估考试化学试卷(解析版) 题型:选择题
将某无色气体X通入品红溶液,溶液褪色;加热,溶液又变红色,X可能是
A. O2 B. Cl2 C. SO2 D. CO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省台州市高一上学期期末质量评估考试化学试卷(解析版) 题型:选择题
下列仪器名称为“分液漏斗”的是
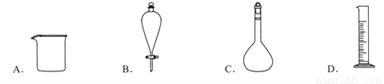
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届陕西省榆林市高考模拟第一次测试理综化学试卷(解析版) 题型:选择题
如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。
下列说法正确的是
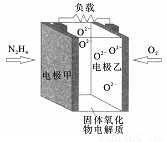
A. 电池内的O2-由电极乙移向电极甲
B. 电池总反应为N2H4+2O2=2NO+2H2O
C. 当甲电极上有1molN2H4消耗时,乙电极上有1mol被氧化
D. 电池外电路的电子由电极乙移向电极甲
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:填空题
(1)若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为_________________。
(2)分子式为C9H20的某烃其一氯代物只有两种产物,写出符合要求的结构简式________________。
(3)分子式为C5H10的烯烃中不存在顺反异构的物质有_____种。
(4)已知烯烃、炔烃在臭氧作用下发生以下反应:
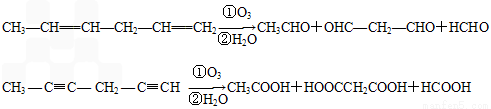
某烃化学式为C10H10,在臭氧作用下发生反应:C10H10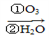 CH3COOH+3HOOC-CHO+CH3CHO ①C10H10分子中含________个双键,________个三键。
CH3COOH+3HOOC-CHO+CH3CHO ①C10H10分子中含________个双键,________个三键。
②C10H10结构简式为________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A. 原电池输出电能的能力,取决于组成原电池的反应物的氧化还原能力
B. 电解质溶液的导电过程,就是电解质溶液的电解过程
C. 铅蓄电池放电时的负极和充电时的阳极均发生还原反应
D. 电化学腐蚀和化学腐蚀都是金属原子失去电子而被氧化的过程
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
下列说法可以证明可逆反应N2+3H2 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N键断裂的 同时,有6个N-H键断裂
同时,有6个N-H键断裂
②v(H2)=0.6 mol·L-1·min-1,v(NH3)=0.4 mol·L-1·min-1
③保持其他条件不变时,体系压强不再改变
④NH3、N2、H2的体积分数都不再改变
⑤恒温恒容时,混合气体质量保持不变
A. ②③④ B. ①③④ C. ①②④ D. ③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com