
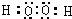 ,实验室常用湿润的红色石蕊试纸检验氨气,方法是:将湿润的红色湿润的石蕊试纸靠近气体,看是否变蓝色,若变蓝色,即为氨气,
,实验室常用湿润的红色石蕊试纸检验氨气,方法是:将湿润的红色湿润的石蕊试纸靠近气体,看是否变蓝色,若变蓝色,即为氨气,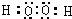 ;将湿润的红色湿润的石蕊试纸靠近气体,看是否变蓝色,若变蓝色,即为氨气;
;将湿润的红色湿润的石蕊试纸靠近气体,看是否变蓝色,若变蓝色,即为氨气;| 19.2g |
| 24g/mol |
| ||
| ||
| aL |
| 22.4L/mol |
| a |
| 112 |
| ||
| a |
| 112 |
| a |
| 56 |
| a |
| 56 |
| 3a |
| 7 |
| 3a |
| 7 |


科目:高中化学 来源: 题型:
| A、胶体和溶液、浊液的本质区别是胶体有丁达尔效应 |
| B、实验室制取氢氧化铁胶体的反应是复分解反应 |
| C、浊液中的粒子不能透过半透膜,胶体和溶液中的粒子则能透过 |
| D、胶体都是无色透明的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
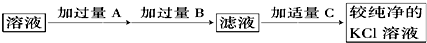
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
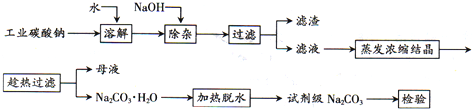
查看答案和解析>>
科目:高中化学 来源: 题型:
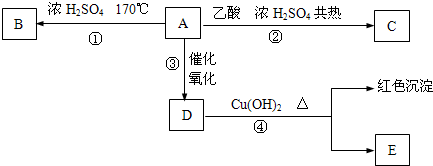
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com