
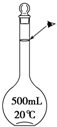
 实验室配制500mL 0.1mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.1mol•L-1的NaCl溶液,有如下操作步骤:分析 解:(1)依据m=CVM计算需要溶质的质量;
依据配制一定物质的量浓度溶液的一般步骤排序;
(2)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器;
(3)俯视刻度线,导致溶液体积偏小,依据C=$\frac{n}{V}$进行误差分析;
(4)若实验过程中加蒸馏水时不慎超过了刻度线,实验失败且不能补救,必须重新配制;
解答 解:(1)配制500mL 0.1mol•L-1的NaCl溶液,需要溶质的质量m=0.1mol/L×58.5g/mol×0.5L=2.9g;
配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,所以正确的顺序为:①②④③⑤;
故答案为:2.9;①②④③⑤;
(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,用到的玻璃仪器:烧杯、玻璃棒、500mL容量瓶、胶头滴管,还缺少的仪器:玻璃棒;
故答案为:玻璃棒;
(3)俯视刻度线,导致溶液体积偏小,依据C=$\frac{n}{V}$可知,溶液浓度偏高;
故选:偏高;
(4)若实验过程中加蒸馏水时不慎超过了刻度线,实验失败且不能补救,必须重新配制;
故答案为:重新配制.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和操作步骤是解题关键,注意误差分析的方法和技巧,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是从源头上消除工业生产对环境的污染 | |
| B. | “硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其与过量的NaOH溶液反应的化学方程式是
,其与过量的NaOH溶液反应的化学方程式是 +2NaOH→
+2NaOH→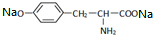 +2H2O.
+2H2O.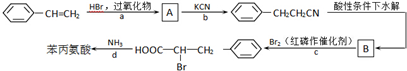
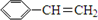 +HBr→
+HBr→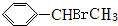 .
. +Br2$\stackrel{红磷}{→}$
+Br2$\stackrel{红磷}{→}$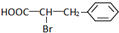 +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他步骤正确,滴定达到终点时,俯视读数,测得c(H+)偏大 | |
| B. | 实验测得25℃时,HgI2的Ksp=4×10-9 | |
| C. | 一定温度下,向HgI2饱和溶液中加入少量Hg(NO3)2溶液,HgI2的Ksp减小 | |
| D. | 温度不变,在t时,向HgI2饱和溶液中加入少量浓KI溶液,离子浓度变化如图所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
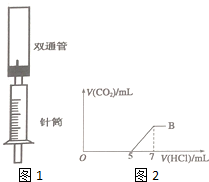 为探究Na2CO3与盐酸的反应原理,设计了如图1实验装置.
为探究Na2CO3与盐酸的反应原理,设计了如图1实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com