
下列关于蒸馏操作的有关叙述不正确的是( )
A. 冷凝管进出水的方向是下进上出
B. 在蒸馏烧瓶内放入少量碎瓷片,目的是防止暴沸
C. 蒸馏操作使用的温度计的水银球应插入到液体内
D. 蒸馏操作主要仪器是:蒸馏烧瓶、酒精灯、铁架台、冷凝管、锥形瓶、温度计等
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源:2016-2017学年四川省高一上半期考试化学卷(解析版) 题型:填空题
铜和浓硫酸发生反应的化学方程式为:Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生 反应;浓H2SO4作_______剂,具有 性。在该反应中,若消耗了32gCu,则转移了_______mol 电子 ,生成 L SO2(标准状况)气体。
CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生 反应;浓H2SO4作_______剂,具有 性。在该反应中,若消耗了32gCu,则转移了_______mol 电子 ,生成 L SO2(标准状况)气体。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省等三校高一上期中化学卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.1 L 1 mol • L—1硫酸溶液中所含的氧原子数为4NA
B.标准状况下,11.2 L CC14中所含的原子数为2.5NA
C.2.7 g A1与足量氧气充分反应,转移的电子数为0.3NA
D.常温常压下,14 g由N2与CO组成的混合气体中所含的原子数为2NA
查看答案和解析>>
科目:高中化学 来源:2017届西藏山南二中高三上11月月考化学试卷(解析版) 题型:选择题
下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A.在空气中敞口久置的浓硫酸,溶液质量增大(脱水性)
B.在加热条件下铜与浓硫酸反应(氧化性、酸性)
C.蔗糖与浓硫酸反应中有海绵状的炭生成(吸水性)
D.浓硫酸可用来干燥某些气体(不挥发性)
查看答案和解析>>
科目:高中化学 来源:2017届西藏山南二中高三上11月月考化学试卷(解析版) 题型:选择题
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.蒸馏、萃取、分液 B.分液、萃取、蒸馏
C.萃取、蒸发、分液 D.分液、蒸馏、萃取
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次段考化学卷(解析版) 题型:实验题
过硫酸钾( )具有强氧化性(常被还原为硫酸钾),80℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
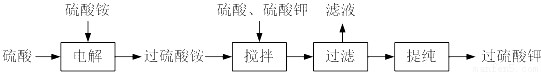
(1)硫酸铵和硫酸配制成电解液,以铂作电极进行电解,生成过硫酸铵溶液。写出电解时发生反应的离子方程式___________________。
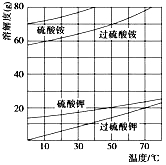
(2)已知相关物质的溶解度曲线如下图所示。在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中,___________,干燥。
(3)样品中过硫酸钾的含量可用碘量法进行测定。实验步骤如下:
步骤1:称取过硫酸钾样品0.3000g于碘量瓶中,加入30 mL水溶解。
步骤2:向溶液中加入4.000g KI固体(略过量),摇匀,在暗处放置30 min。
步骤3:在碘量瓶中加入适量醋酸溶液酸化,以淀粉溶液作指示剂,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液21.00mL。
(已知反应:I2+2S2O32-=2I-+S4O62-)
①若步骤2中未将碘量瓶“在暗处放置30 min”,立即进行步骤3,则测定的结果可能__________(选填“偏大”、“偏小”、“无影响”);上述步骤3中滴定终点的现象是__________。
②根据上述步骤可计算出该样品中过硫酸钾的质量分数为__________。
③为确保实验结果的准确性,你认为还需要____________________。
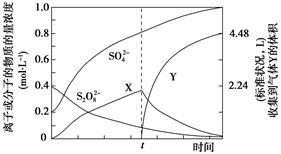
(4)将0.40mol过硫酸钾与0.20mol硫酸配制成1 L溶液,在80℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如图所示(H+浓度未画出)。图中物质X的化学式为
__________。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次段考化学卷(解析版) 题型:选择题
已知:SO32-+I2+H2O→SO42-+2I-+2H+。某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32- 、SO42-,且所有离子物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是
A.肯定不含I- B.可能含有SO42- C.肯定含有SO32- D.肯定含有NH4+
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上月考四化学卷(解析版) 题型:选择题
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol/L的 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.开始加人合金的质量可能为16.4 g
B.产物NO的体积为2.24 L
C.参加反应的硝酸的物质的量为0.1 mol
D.生成沉淀完全时消耗NaOH溶液的体积为100 mL
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上期中化学卷(解析版) 题型:选择题
下列说法正确的是
A.1 mol任何物质都含有6.02×1023个分子
B.标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4 L
C.HNO3的摩尔质量是 63 g
63 g
D.0.5 mol 13H原子含有的中子数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com