
【题目】科学家预测原子序数为114的元素,具有相当稳定性的同位素,它的位置在第7周期IVA族,称为类铅。关于它的性质,预测错误的是
A.它的最外层电子数为4B.它的金属性比铅强
C.它具有+2、+3、+4价D.它的最高价氧化物的水化物是强酸
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A. 已知2H2(g)+O2(g) =2 H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热△H=-241.8 kJ/mol
B. 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2
C. 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq) = CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1
D. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+566.0 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①已知t ℃时AgCl的Ksp为2×10-10;②在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A. t ℃时,Ag2CrO4的Ksp为1×10-9
B. 在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C. t ℃时,反应Ag2CrO4(s)+2Cl-(aq) ![]() 2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
D. t ℃时,用0.01 mol·L-1 AgNO3溶液滴定20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1的K2CrO4的混合溶液,CrO42-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制取N2O气体。
(1)连二次硝酸中氮元素的化合价为_______。
(2)常温下,用0.01 mol·L-1的NaOH溶液滴定10 mL 0.01 mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:_________。
②B点时溶液中c(H2N2O2)___ c(N2O22-)(填“>”、“<”或“=”)。
③A点时溶液中c(Na+)___(HN2O22-)+c(N2 O22-)(填“>”、“<”或“=”)。
(3)已知常温下Ksp(Ag2SO4)=1.4×10-5,Ksp(Ag2N2O2)=4.2×10-9。硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中 ____。
____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度和压强下,把装有NO和NO2的混合气体的试管倒立于水中,充分反应后,试管内气体的体积缩小为原气体体积的![]() ,则原混合气体中NO和NO2的体积比为( )
,则原混合气体中NO和NO2的体积比为( )
A. 3∶lB. 1∶3C. 2∶3D. 3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,能说明氯元素的非金属性比硫元素的非金属性强的是( )
①盐酸的酸性比氢硫酸(H2S水溶液)酸性强 ②HCl的稳定性比H2S强 ③相同条件下,Cl2与铁反应生成FeCl3 ,而S与铁反应生成FeS ④Cl2能与H2S反应生成S ⑤酸性强弱:硫酸<高氯酸
A. ①②③④B. ②③④C. ①②③④⑤D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用如图装置制取、净化、收集气体的是
选项 | 气体 | ① | ② | ③ |
|
A | NH3 | 浓氨水 | 生石灰 | 浓硫酸 | |
B | SO2 | 浓硫酸 | Na2SO3 | 浓硫酸 | |
C | NO2 | 浓硝酸 | 铜屑 | H2O | |
D | Cl2 | 浓盐酸 | MnO2 | H2O |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图虚线框中的装置可用来检验浓硫酸与木炭粉的加热条件下反应产生的所有气体产物,填写下列空白:

(1)如果装装置中①、②、③三部分仪器的连接顺序改为②、①、③,则可以检出的物质是____________;不能检出的物质是____________。
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是____________;不能检出的物质是____________。
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是____________;不能检出的物质是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,答下列问題:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2该反应氧化剂与还原剂物质的量之比为_______________。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
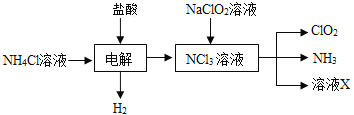
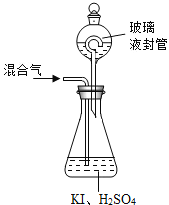
图1 图2
①电解时发生反应的化学方程式为_______________________________________________ 。
②溶液X中大量存在的阴离子有________________________________________________ 。
③除去ClO2中的NH3可选用的试剂是 ___________________(填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(3)用上图2装置可以测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入 3 mL 稀硫酸:
Ⅱ.在玻璃液封装置中加入水.使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为_______________________________。
②玻璃液封装置的作用是________________________________________________。
③V中加入的指示剂通常为___________,滴定至终点的现象是_________________________。
④测得混合气中ClO2的质量为____________________________ g.。
(4)O2处理过的饮用水会含有一定最的亚氯酸盐。若要除去超标的亚氯酸盐,下列物庾最适宜的是________(填标号)。
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com