
用一价离子组成的四种盐溶液:AC、BD、AD、BC,其物质的量浓度均为1 mol/L。在室温下前两种溶液的pH=7,第三种溶液的pH>7,最后一种溶液pH<7,则正确的是( )
| A | B | C | D | |
| 碱性 | AOH>BOH | AOH<BOH | AOH>BOH | AOH<BOH |
| 酸性 | HC>HD | HC>HD | HC<HD | HC<HD |
科目:高中化学 来源: 题型:
工业上用粗氧化铜(含杂质FeO)为原料制取氯化铜晶体(CuCl2·2H2O)的生产流程如下:
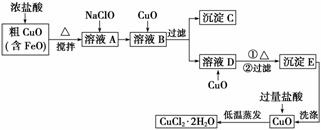
(1)浓盐酸溶解粗CuO时可能发生的离子方程式______________、____________。
(2)写出向溶液A中加入NaClO的离子方程式:__________________________________。
(3)用沉淀C制取FeCO3的流程如下:
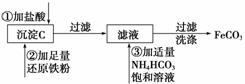
完成上述转化过程中的离子方程式
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应不属于水解反应或水解方程式不正确的是( )
①HCl+H2O  H3O++Cl- ②AlCl3+3H2O =Al(OH)3+3HCl
H3O++Cl- ②AlCl3+3H2O =Al(OH)3+3HCl
③Na2CO3+2H2O  H2CO3+2NaOH ④碳酸氢钠溶液:HCO3-+H2O
H2CO3+2NaOH ④碳酸氢钠溶液:HCO3-+H2O  CO32-+H3O+
CO32-+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O  NH3·D2O+H+
NH3·D2O+H+
A.①②③④ B.①②③ C.②③⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温条件下,欲使CH3COONa的稀溶液中c(CH3COO-)/c(Na+)比值增大,可在溶液中加入少量下列物质中的 ( )
①固体NaOH ②固体KOH ③固体NaHCO3 ④固体CH3COONa ⑤冰醋酸
A.只有①② B.只有②⑤ C.只有②④⑤ D.只有①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表
请回答:
(1)从①组情况分析,HA是________(填“强酸”或“弱酸”)。
(2)②组情况表明,c________0.2mol/L(选填“大于”、“小于”或“等于”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系________________________。
(3)从③ 组实验结果分析,说明HA的电离程度________NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.室温下,HClO分子不可能存在于c(OH-)>c(H+)的溶液中
B.室温下,在pH=7的溶液中,CH3COO-不可能大量存在
C.漂白粉只有在酸的存在下生成次氯酸才具有漂白作用
D.c(CH3COO-)=c(Na+)的CH3COOH和CH3COONa的混合溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。
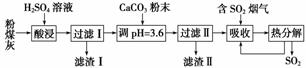
(1)酸浸时反应的化学方程式为________________________________;滤渣Ⅰ的主要成分为________________(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为________________________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是
________________________________________(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是
________________________________;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:
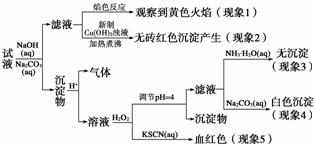
已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是( )
A.根据现象1可推出该试液中含有Na+
B.该实验中可加入MgO调节pH=4
C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D.根据现象5可推出该试液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO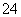 )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为 ( )
)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为 ( )
A.9.0 L B.13.5 L
C.15.7 L D.16.8 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com