
| A. | 0.1mol/L Na2CO3溶液:c(OH-)+c(H+)═c(HCO3-)+2c(H2CO3) | |
| B. | 0.1mol/L NH4Cl溶液:c(NH4+)+c(Cl-)═0.2mol/L | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到的pH=4的混合溶液:c(Na+)═c(NO3-) | |
| D. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
分析 A.根据质子守恒分析;
B.铵根离子水解,浓度减小;
C.根据物料守恒分析;
D.根据电荷守恒分析.
解答 解:A.0.1mol/L Na2CO3溶液中存在质子守恒:c(OH-)═c(HCO3-)+2c(H2CO3)+c(H+),则c(OH-)-c(H+)═c(HCO3-)+2c(H2CO3),故A错误;
B.铵根离子水解,浓度减小,所以c(NH4+)<0.1mol/L,则c(NH4+)+c(Cl-)<0.2mol/L,故B错误;
C.硝酸钠溶液中硝酸根离子和钠离子都不水解,所以由物料守恒可知,c(Na+)═c(NO3-),故C正确;
D.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液,溶液中电荷守恒为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),当c(H+)>c(OH-),则c(Na+)<c(CH3COO-),故D错误.
故选C.
点评 本题考查了酸碱混合的定性判断、离子浓度大小比较,题目难度中等,注意根据电荷守恒、物料守恒及盐的水解原理判断离子浓度大小,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:多选题
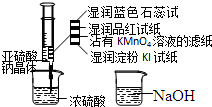 如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )| A. | 湿润淀粉碘化钾试纸未变蓝说明硫元素的非金属性强于碘元素 | |
| B. | 沾有KMnO4溶液的滤纸褪色证明了SO2具有漂白性 | |
| C. | 实验后,可把注射器中的物质缓缓推入NaOH溶液中,以减少环境污染 | |
| D. | 蓝色石蕊试纸变红说明SO2溶于水显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) | B. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | ||
| C. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | D. | c(H+)>c(Cl-)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
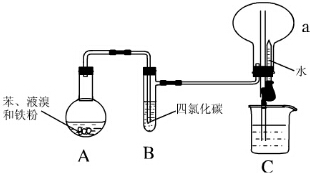 Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.
Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 加入物质 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 9mL 5% H2O2溶液 | 1mL 水 |
| ④ | 9mL 5% H2O2溶液 | 1mL 0.1mol•L-1 HCl溶液 |
| ⑤ | 9mL 5% H2O2溶液 | 1mL 0.1mol•L-1 NaOH溶液 |

| 物理量 实验序号 | V[30% H2O2]/mL | … | |
| 1 | a | … | |
| 2 | a | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
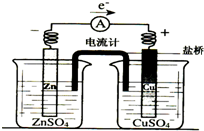
| A. | 铜片上有气泡逸出 | |
| B. | 取出盐桥后,电流计依然发生偏转 | |
| C. | 反应中,盐桥中的K+会移向CuSO4溶液 | |
| D. | 铜片上发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com