
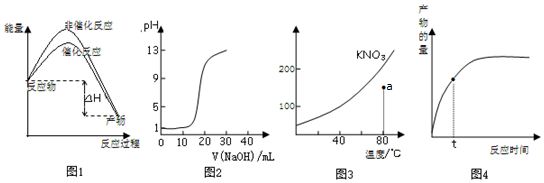
| A. | 图1表示加入催化剂不影响反应的焓变 | |
| B. | 图2表示用0.10mol/L CH3COOH溶液滴定20.00 mL0.10mol/LNaOH溶液所得到的滴定曲线 | |
| C. | 图3表示KNO3的溶解度曲线,图中点所示的溶液是80℃时KNO3的不饱和溶液 | |
| D. | 图4表示t时正反应速率大于逆反应速率 |
分析 A、反应物的总能量大于生成物的总能量为放热反应,使用催化剂可以降低活化分子需要能量;
B、醋酸是弱酸,不能完全电离,据此计算0.10mol/L CH3COOH溶液pH;
C、a点时溶解的硝酸钾的质量小于80℃时KNO3的溶解度,说明该溶液为不饱和溶液;
D、正反应速率大于逆反应速率,反应正向进行,产物的量逐渐增加.
解答 解:A.反应物的总能量大于生成物的总能量为放热反应,因此图象表示的为放热反应;使用催化剂能够降低活化分子能量,使用催化剂时需要能量低于不使用催化剂的能量,该图示与对应的叙述相符,故A正确;
B、醋酸是弱酸,不能完全电离,计算0.10mol/L CH3COOH溶液pH大于1,和图象不符,故B错误;
C.曲线上所有的点代表相应温度下KNO3溶液的溶解度,均为饱和溶液,a点溶解的KNO3的质量远小于饱和时的数值,因此a点所示的溶液是80℃时KNO3的不饱和溶液,该说法错误,故C正确;
D、正反应速率大于逆反应速率,反应正向进行,产物的量逐渐增加,该图示与对应的叙述相符,故D正确.
故选B.
点评 本题考查反应热和焓变、溶解度和饱和溶液、反应速率与化学平衡的关系,题目难度中等,注意明确饱和溶液概念、反应速率与化学平衡的关系,试题侧重考查学生运用所学原理从图象中获取信息、分析问题、及解决问题的能力.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{12}$% | B. | $\frac{a}{27}$% | C. | $\frac{1}{9}-\frac{a}{27}$% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2溶于水生成的H2SiO3的酸性弱于H2CO3 | |
| B. | SiO2是一种空间立体网状结构的晶体,熔点高、硬度大 | |
| C. | 在SiO2晶体中,每个硅原子周围结合2个氧原子 | |
| D. | SiO2是一种酸性氧化物,所以不和任何酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2B溶液中一定有:c(OH-)=c(H+)+c(HB-)+2c(H2B) | |
| B. | NaHB溶液可能存在以下关系:c(Na+)>c(HB-)>c(OH-)>c(H+) | |
| C. | NaHB水溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+c(B2-) | |
| D. | NaHB溶液一定呈酸性,Na2B溶液一定呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
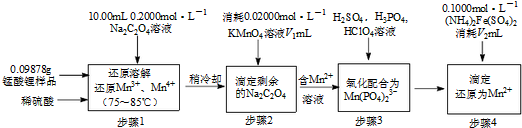
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②③⑤ | D. | ①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1的Na2CO3溶液中离子浓度关系:c (Na+)=2c (CO32-)+c (HCO3-)+c (H2CO3) | |
| B. | 0.01mol•L-1的NH4Cl和0.01mol•L-1的NH3•H2O等体积混合后,若测得溶液中c (Cl-)>c (NH4+),则溶液中有关微粒的浓度关系: c (Cl-)>c (NH3•H2O)>c (NH4+)>c (H+)>c (OH-) | |
| C. | 0.1mol的NaHS和0.1mol的NaHSO4混合溶于水,配制成1L溶液,则混合溶液中离子浓度关系为:c (Na+)-0.1mol•L-1=2c (S2-)+c (H2S)+c (HS-) | |
| D. | 0.1mol•L-1的NaHCO3溶液中离子浓度关系:c (OH-)=c (H+)+c (H2CO3)-c (CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
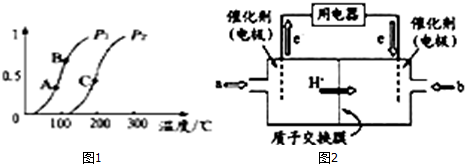
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com