
有25℃时0.1 mol/L的①氯化铵、②氯化钠、③醋酸钠三种溶液。下列有关判断不正确的是
| A.①与②比较:c(Na+)>c(NH4+) |
| B.①中离子浓度的大小关系是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.①和②等体积混合的溶液中:c(Cl-)=c(Na+)+c(NH4+)+c(NH3·H2O) |
| D.向③中滴加适量醋酸溶液,使溶液pH=7,则:c(CH3COO-)>c(Na+) |
D
解析试题分析:A、①与②比较:NH4+水解使离子浓度小于0.1mol/L,而Na+不水解,离子浓度等于0.1mol/L,正确;B、氯化铵因为铵根离子的水解而使溶液显酸性,所以离子浓度的大小关系是c(Cl-)>c(NH4+)>c(H+)>c(OH-),正确;C、氯化铵与氯化钠的浓度相同,等体积混合,根据物料守恒规律,氯元素的浓度与钠元素和氮元素的浓度和相等,正确;D、pH=7说明溶液呈中性,c(H+)=c(OH-),根据电荷守恒规律,c(CH3COO -)+ c(OH-)= c(Na+)+ c(H+),所以c(CH3COO -)=c(Na+),错误,答案选D。
考点:考查盐的水解,离子浓度的大小比较,混合液的物料守恒规律、电荷守恒规律的应用


科目:高中化学 来源: 题型:单选题
25℃ 时,水的离子积为Kw,该温度下将 a mol ·L-1一元酸 HA 与b mol·L-1一元强碱BOH 等体积混合,若恰好完全反应,下列结论中不正确的是
A. 混合液中:c(H+ ) ≤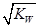 B. 混合液中:c(HA)+c(A-)=a mol·L-1
B. 混合液中:c(HA)+c(A-)=a mol·L-1
C. a = b D. 混合液中:c(H+)+c(B+)= c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有浓度均为0.1mol/L三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
| A.溶液①中,c(CH3COO-)=c(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- ) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+) |
| D.溶液①、③等体积混合,混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列溶液中,微粒浓度关系正确的是
| A.含有NH4+、Cl-、H+、OH-离子的溶液中,其离子浓度一定是: c(Cl-)>c(NH4+)> c(H+)> c(OH-) |
| B.pH=6的醋酸与醋酸钠的混合溶液中c(Na+)>c(CH3COO-) |
| C.0.lmol/L的Na2S溶液中,c(OH-)= c(H+)+ c(HS-)+2 c(H2S) |
| D.pH=3的一种酸和pH=11的一种碱等体积混和后的溶液中一定是c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列溶液中有关物质的浓度关系正确的是
A.c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl溶液中: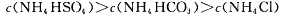 |
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中: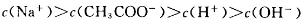 |
C.1.0mol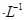 Na2CO3溶液中: Na2CO3溶液中: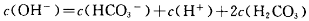 |
| D.某二元弱酸的酸式盐NaHA溶液中: |
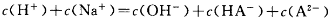
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列图示与对应的叙述相符的是
| A.图甲中曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉,产生H2的物质的量的变化 |
| B.图乙表示用0.1000 mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由曲线可确定③的酸性最强 |
| C.图丙为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
| D.图丁表示将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,二者pH的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是 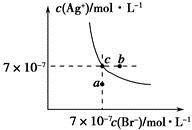
| A.在t℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t℃时,AgCl(s)+Br-(aq)  AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol·L-1,则该溶液中溶质的pC=3。下列表达正确的是
A某温度下任何电解质的水溶液中,pC(H+) +pC(OH-)=14
B 0.01mol/L的CaCl2溶液中逐渐滴加纯碱溶液,滴加过程中pC(Ca2+)逐渐减小
C用0.01mol/L的盐酸滴定某浓度的NaOH溶液,滴定过程中pC(H+)逐渐增大
D.某温度下,AB难溶性离子化合物的Ksp=1.0×10-10, 其饱和溶液中pC(A+) +pC((B-)=10
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1 Na2SO4溶液,下列叙述正确的是
| A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大 |
| B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小 |
| C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小 |
| D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com