
| A. | 灼热的炭与二氧化碳反应 | B. | 铁和稀硫酸的反应 | ||
| C. | 氢氧化钡晶体的粉末和稀硫酸混合 | D. | 木炭在氧气中燃烧 |
分析 反应物总能量高于反应物总能量,应为放热反应,常见放热反应有大多数化合反应、酸碱中和反应、金属与酸的反应,物质的燃烧等,
生成物总能量高于反应物总能量,应为吸热反应,常见吸热反应有大多数分解反应,C、CO等还原剂与金属氧化物的反应,Ba(OH)2•8H2O与NH4Cl反应等,
反应中反应物的总能量比生成物低,反应是吸热反应,以此分析选项.
解答 解:反应中反应物的总能量比生成物低,说明反应是吸热反应;
A、灼热的炭与二氧化碳反应生成CO,此反应属于吸热反应,故A正确;
B、铁和稀硫酸的反应是发生的氧化还原反应,反应放热,故B错误;
C、氢氧化钡晶体的粉末和稀硫酸混合是酸碱中和反应,属于放热反应,故C错误;
D、木炭在氧气中燃烧是放热反应,故D错误;
故选A.
点评 本题考查反应热与焓变,侧重于基础知识的考查,为高频考点,注意把握常见吸热反应与放热反应,学习中注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Pt电极电解少量的MgCl2溶液:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| B. | H${\;}_{2}^{18}$O中投入Na2O2固体:2H${\;}_{2}^{18}$O+2O${\;}_{2}^{2-}$═4OH-+18O2↑ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | FeSO4溶液中加H2O2溶液:Fe2++2H2O2+4H+═Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 25℃平衡体系 | HA起始总浓度 |
| 在水中,HA═H++A- | 4.0×10-3mol•L-1 |
| 在苯中,2HA═(HA)2 | 5.0×10-3mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 粒子 | 操作 | 现象 | 现象 | |
| a | H+ | |||
| b | Cl- | |||
| c | Cl2 | |||
| d | HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
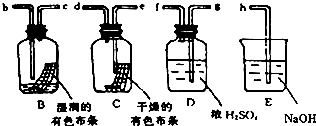
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12△H3+5△H2-2△H1 | B. | 2△H1-5△H2-12△H3 | C. | 12△H3-5△H2-2△H1 | D. | △H1-5△H2-12△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲溶液中含有HCO3- | B. | 乙溶液中含有SO42- | ||
| C. | 丙溶液中含有Mg2+ | D. | 丁溶液中含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 浓度均为0.1mol--1L的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] | |
| C. | 将pH=a的醋酸稀释为pH=a+1的过程中,$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$不变 | |
| D. | 0.2mol-L-1 CH3COOH溶液中c(H+)与 0.1mol-L-1 CH3COOH溶液中c(H+)的比值小于2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com