
 分子式为CmH20的烷烃中m为9,分子中含有22个共价键的烷烃的分子式:C7H16,与CO2的密度(同温同压)相同的烷烃分子式为的C3H8.若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是(填分子式)C9H20.
分子式为CmH20的烷烃中m为9,分子中含有22个共价键的烷烃的分子式:C7H16,与CO2的密度(同温同压)相同的烷烃分子式为的C3H8.若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是(填分子式)C9H20.分析 (1)乙烷的分子式为C2H6,根据原子成键特点写出结构式,根据烷烃的通式CxH2x+2来计算m,令烷烃的组成为CnH2n+2,含有的共价键数目为3n+1,据此可知有22个共价键的烷烃中碳原子数目为7,与CO2 密度(同温同压)相同的烷烃,其相对分子质量应该和二氧化碳的相等,烃燃烧耗氧量取决于C、H原子个数的大小,1mol烃的耗氧量=C原子个数+$\frac{氢原子个数}{4}$;
(2)质量相同时,分子中H元素的质量分数越大,完全燃烧时消耗O2越多.
解答 解:(1)因碳原子的最外层有4个电子,氢原子最外层1个电子,一个碳原子形成4对共用电子对,一个氢原子形成一对共用电子对,所以结构式为 ;据烷烃的通式CxH2x+2,分子式为CmH20的烷烃中m为9,令烷烃的组成为CnH2n+2,含有的共价键数目为3n+1,该烷烃有22个共价键,则:3n+1=22,解得,n=7,所以该烷烃中碳原子数目为7,分子式为C7H16,与CO2 密度(同温同压)相同的烷烃分,其相对分子质量应该和二氧化碳的相等,即为44,分子式为C3H8,若上述四种烃各为1mol,1mol烃的耗氧量=C原子个数+$\frac{氢原子个数}{4}$;分别是1molC2H6、C9H20、C8H18、C3H8在足量O2中燃烧,消耗O2分别是:3.5mol、14mol、12.5mol、5mol,所以耗O2最多的是C9H20,
;据烷烃的通式CxH2x+2,分子式为CmH20的烷烃中m为9,令烷烃的组成为CnH2n+2,含有的共价键数目为3n+1,该烷烃有22个共价键,则:3n+1=22,解得,n=7,所以该烷烃中碳原子数目为7,分子式为C7H16,与CO2 密度(同温同压)相同的烷烃分,其相对分子质量应该和二氧化碳的相等,即为44,分子式为C3H8,若上述四种烃各为1mol,1mol烃的耗氧量=C原子个数+$\frac{氢原子个数}{4}$;分别是1molC2H6、C9H20、C8H18、C3H8在足量O2中燃烧,消耗O2分别是:3.5mol、14mol、12.5mol、5mol,所以耗O2最多的是C9H20,
故答案为: ;9;C7H16;C3H8;C9H20;
;9;C7H16;C3H8;C9H20;
(2)CH4 、C2H6、C3H8 、C4H10的H%大小为:CH4>C2H6>C3H8>C4H10,质量相同时,分子中H元素的质量分数越大,完全燃烧时消耗O2越多,消耗O2最多的是CH4,
故答案为:CH4.
点评 本题考查烃燃烧耗氧量以及结构式的书写、烷烃的通式的应用等问题,难度不大,注意对规律的理解与掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
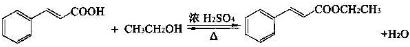
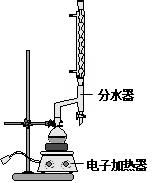
| 名称 | 相对分子质量 | 原色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 肉桂酸 | 148 | 白色晶体 | 300 | 1.2475 |
| 肉桂酸乙酯 | 176 | 无色油状液体 | 271.5 | 1.0491 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同物质的量浓度的Na2Y和NaHY溶液,前者的pH大于后者 | |
| B. | NaHY的溶液中,离子浓度大小顺序为:c(Na+)>c(Y-)>c(HY-)>c(OH-)>c(H+) | |
| C. | HY-的水解离子方程式为:HY-+H2O?Y-+H3O+ | |
| D. | 在Na2Y、NaHY、H2Y的溶液中,阴离子的种类不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 复分解反应 | B. | 离子反应 | C. | 置换反应 | D. | 蒸发结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
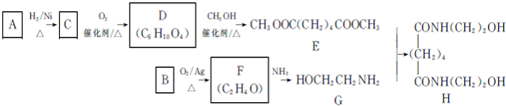
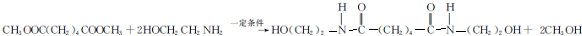 .
.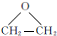 ,能发生银镜反应的F的同分异构体是CH3CHO.
,能发生银镜反应的F的同分异构体是CH3CHO.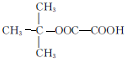 (写结构简式).
(写结构简式).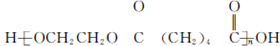 的合成路线:
的合成路线: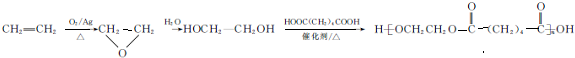 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,名称为2,3-二甲基-2-丁烯.A中的碳原子是否都处于同一平面?是(填“是”或“不是”).
,名称为2,3-二甲基-2-丁烯.A中的碳原子是否都处于同一平面?是(填“是”或“不是”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
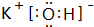 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com