
(14分)制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42 -等离子,过程如下:
Ⅰ. 向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ. 向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ. 滤液用盐酸调节pH,获得第一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20 ℃/g)如下表,请依据表中数据解释下列问题:
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
①过程Ⅰ选用BaCl2而不选用CaCl2的原因为___________________________________。
②过程II之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,原因是____________。
(3)第二次精制要除去微量的I-、IO3- 、NH4+ 、Ca2+、Mg2+,流程示意如下:
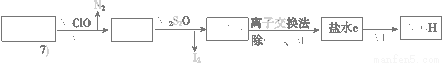
① 过程Ⅳ除去的离子有______、_______。
② 盐水b中含有SO42 -。Na2S2O3将IO3- 还原为I2的离子方程式是___________________________。
③ 过程VI中,产品NaOH在电解槽的__________区生成(填“阳极”或“阴极”),该电解槽为______离子交换膜电解槽(填“阳”或“阴”)。
(1)SO42 -
(2)①BaSO4的溶解度比CaSO4的小,可将SO42 -沉淀更完全
②在BaCO3、CaCO3、Mg2(OH)2CO3 中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+ 和Ca2+也沉淀完全
(3)① NH4+ 、I-
② 5S2O32 -+8IO3- +2OH- = 4I2+10SO42 -+H2O
③阴极,阳
【解析】
试题分析:⑴加入过量BaCl2溶液能除去粗盐水中的SO42 -;
⑵①由于BaSO4的溶解度比CaSO4的小,用CaCl2不能将SO42 -沉淀完全,故选用BaCl2才能将其除尽;
②在BaCO3、CaCO3、Mg2(OH)2CO3等沉淀中,BaCO3的溶解度相对最大,若Ba2+沉淀完全,则说明Mg2+ 和Ca2+也沉淀完全;
⑶①NaClO有强氧化性能将NH4+ 、I-等分别氧化为N2、IO3- 除去
②据题意首先根据得失电子守恒有5S2O32 -+8IO3- +2OH-―― 4I2+10SO42 -+H2O,再根据电荷守恒有5S2O32 -+8IO3- +2OH-――4I2+10SO42 -+H2O,最后根据原子守恒得5S2O32 -+8IO3- +2OH- = 4I2+10SO42 -+H2O。
③电解饱和食盐水在阴极区得NaOH和H2,在阳极区得Cl2,用阳离子交换膜(只允许阳离子通过、阴离子和气体不能通过)能阻止Cl2与NaOH、H2混合反应。
考点:本题考查粗盐的提纯、氧化还原反应类型的离子方程式书写、氯碱工业等。


科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为1 mol·L-1 B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:填空题
(6分)1.52g铜镁合金完全溶解于50mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
(1)该合金中铜与镁的物质的量之比是 。
(2)NO2和N2O4的混合气体中,NO2的体积分数是 。
(3)得到2.54 g沉淀时,加入NaOH溶液的体积是 mL。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
几种短周期元素的原子半径和主要化合价见下表,下列说法中正确的是( )。
元素代号 | 原子半径/nm | 主要化合价 |
X | 0.160 | +2 |
Y | 0.143 | +3 |
Z | 0.102 | +6、-2 |
L | 0.099 | +7、-1 |
M | 0.077 | +4、-4 |
Q | 0.074 | -2 |
A.等物质的量的X、Y的单质与足量的盐酸反应,生成的H2一样多
B.Y与Q形成的化合物不能跟氢氧化钠溶液反应
C.Z的氢化物的稳定性强于L的氢化物的稳定性
D.在化学反应中,M原子与其他原子易形成共价键而不易形成离子键
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高三终极预测理综化学试卷(解析版) 题型:推断题
【化学——选修5:有机化学基础】(15分)
化合物H可用以下路线合成:
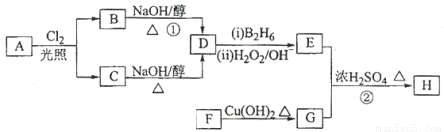
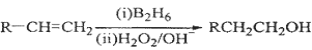
已知:
请回答下列问题:
(1)标准状况下11.2 L烃A在氧气中充分燃烧可以生成88 g CO2和45 g H2O,且A分子结构中有3个甲基,则A的结构简式为 ;
(2)B和C均为一氯代烃,D的名称(系统命名)为 ;
(3)在催化剂存在下1 mol F与2 mol H2反应,生成3—苯基—1—丙醇。F的结构简式是 ;
(4)反应①的反应类型是 ;
(5)反应②的化学方程式为 ;
(6)写出所有与G具有相同官能团的芳香类同分异构体的结构简式
。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高三终极预测理综化学试卷(解析版) 题型:选择题
下列解释实验事实的方程式正确的是
A.Al2(SO4)3溶液滴加氨水产生白色胶状沉淀: Al3++3OH- = Al(OH)3↓
B.90 ℃时,测得纯水中c(H+)·c(OH-) =3.8×10—13: H2O(l)  H+(aq)+OH-(aq) ?H<0
H+(aq)+OH-(aq) ?H<0
C.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2 +2H2O = 2Fe2++SO42 -+ 4H+
D.碳酸钠溶液滴入酚酞变红:CO32 -+ 2H2O  H2CO3+2OH-
H2CO3+2OH-
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
(14分)镍是一种十分重要的有色金属,但粗镍中一般含有Fe、Cu及难与酸、碱溶液反应的不溶性杂质而影响使用。现对粗镍进行提纯,具体的反应流程如下:
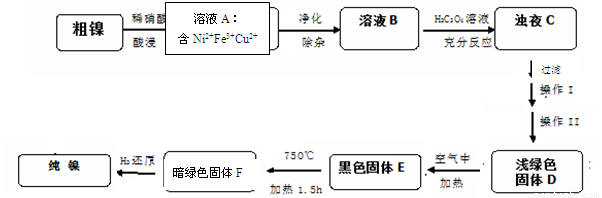
已知:
①2Ni2O3 (黑色)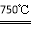 4NiO(暗绿色) + O2↑
4NiO(暗绿色) + O2↑
②
物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS |
Ksp | 8.8×10-36 | 2.2×10-20 | 5.48×10-16 | 3.2×10-19 |
根据信息回答:
(1)28Ni在周期表中的第 周期;镍与稀硝酸反应的离子方程式为 。实验表明镍的浸出率与温度有关,随着温度升高镍的浸出率增大,但当温度高于70℃ 时,镍的浸出率又降低,浸出渣中Ni(OH)2含量增大,其原因为 ;
(2)在溶液A的净化除杂中,首先将溶液A煮沸,调节PH=5.5,加热煮沸5min,静置一段时间后,过滤出Fe(OH)3。为了得到纯净的溶液B还需要加入以下物质 进行除杂(填正确答案标号)。
A、NaOH B、Na2S C、H2S D、NH3﹒H2O
(3)已知以下三种物质的溶解度关系:NiC2O4>NiC2O4·H2O> NiC2O4·2H2O。则操作I、II名称是 、 ; D生成E的化学方程式为 。
(4)1molE经上述流程得到纯镍,理论上参加反应的氢气为 mol。
(5)测定样品中的镍含量的基本思路是将Ni2+转化为沉淀,通过测量沉淀的质量进一步推算Ni含量。已知Ni2+能与CO32-,C2O42-、S2-等离子形成沉淀,但测定时常选用丁二酮肟(C4H8N2O2)作沉淀剂,生成分子式为C8H14N4O4Ni的鲜红色沉淀。从实验误差角度分析主要原因为: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
①如果某化合物只含共价键,则其一定是共价化合物
②有阴离子存在的物质中一定存在阳离子
③碳、氮形成的氢化物常温下都是气态
④非金属单质在反应中都只能作氧化剂,具有强氧化性
⑤金属氧化物不一定是碱性氧化物
⑥稀有气体不活泼是因为它们原子最外层都达到8e-稳定结构
A.①②⑤ B.②③④ C.①②⑥ D.②③⑤
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列关于有机物的描述中正确的是( )
A.葡萄糖和果糖互为同分异构体,淀粉和纤维素也互为同分异构体
B.利用蛋白质的颜色反应可以鉴别所有的蛋白质
C.多糖、蛋白质、脂肪和聚丙烯等都属于高分子化合物
D.食醋中的主要成分为乙酸,普通食醋中含有3%- 5%的乙酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com