
含有农药、染料、酚、氰化物,以及引起色度、臭味的废水,常用化学氧化法进行处理,所用的氧化剂有氯类(如液氯、次氯酸钙、次氯酸钠等)和氧类(如空气、臭氧、过氧化氢、高锰酸钾等)。一个典型实例是用氯氧化法处理含有剧毒的氰化物(含CN-)的废水。在碱性条件下(pH=8.5~11),氯气可将氰化物中CN-氧化为只有它毒性 的氰酸盐(含CNO-)。
的氰酸盐(含CNO-)。
(1)写出含CN-废水用氯气氧化生成氰酸盐的离子方程式:________________________________________________________________。
(2)若向含CNO-的废水中再通入氯气,可使CNO-转化为无毒的气体,写出这个反应的离子方程式:______________________________________________。
(3)在用液氯不便的地区,可用漂白粉处理含CN-的废水,若将其氧化为CNO-,其离子方程式为__________________________________________。
(1)CN-+Cl2+2OH-=CNO-+2Cl-+H2O
(2)2CNO-+3Cl2+8OH-=2CO32-+6Cl-+4H2O+N2
(3)CN-+ClO-=CNO-+Cl-
【解析】(1)CN-是在碱性条件下被Cl2氧化的,故反应物应有OH-参加,产物除生成氰酸盐外还应有Cl-及H2O,离子方程式为CN-+Cl2+2OH-=CNO-+2Cl-+H2O。
(2)当Cl2过量时(1)中的产物CNO-与Cl2反应,碱性条件下不可能产生CO2及其他气体,而碳元素的存在形式为CO32-,无毒气体一定为N2,离子方程式:2CNO-+3Cl2+8OH-=2CO32-+6Cl-+4H2O+N2。
(3)由于漂白粉中的ClO-具有强氧化性,故可发生反应:CN-+ClO-=CNO-+Cl-。


科目:高中化学 来源:2014年高二化学苏教版选修2 2专题综合检测练习卷(解析版) 题型:选择题
天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如下图所示:
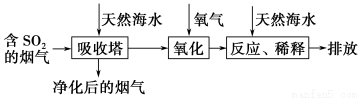
下列说法错误的是( )。
A.天然海水pH≈8的原因是海水中的CO32-、HCO3-水解
B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42-
C.“反应、稀释”时加天然海水的目的是中和、稀释经氧气氧化后海水中生成的酸
D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 1专题综合检测练习卷(解析版) 题型:选择题
铁酸钠(Na2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe3+。
(1)铁酸钠中铁元素的化合价为________。铁酸钠能消毒杀菌,这是因为它具有________性。
(2)铁酸钠用于水处理时,除了能消毒杀菌外,还能沉降水中的悬浮杂质,起到净水作用,请说明其净水原理__________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 1.3海水淡化练习卷(解析版) 题型:选择题
下列说法中,不正确的是( )。
A.蒸馏法淡化海水是将水加热到105 ℃蒸发汽化,然后将蒸气冷凝而得到蒸馏水的方法
B.天然水里一般溶有Ca2+、Mg2+等金属阳离子,我们把溶有较多量Ca2+、Mg2+的水称为硬水
C.阳离子交换树脂中的H+可与水中的金属阳离子Mn+交换
D.阴离子交换树脂中既含有阳离子,又含有阴离子,因此既能与水中的阳离子交换,又能与水中的阴离子交换
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 1.2硬水软化练习卷(解析版) 题型:选择题
关于离子交换法软化硬水,下列叙述中正确的是( )。
A.磺化媒能使永久硬水软化,因其有效地除去了水中的Ca2+、Cl-、SO等离子
B.经磺化媒软化处理后,水中Na+浓度增大
C.经磺化媒软化处理后,从水中可分离出CaCO3、Mg(OH)2等难溶物
D.磺化媒软化硬水,使水中Ca2+、Mg2+浓度减小
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 1.1水的净化与污水处理练习卷(解析版) 题型:选择题
2010年上海世博会的主题是“城市,让生活更美好”。下列叙述中不正确的是( )。
A.世博会前期,处理废水时加入明矾可作为混凝剂以吸附水中的杂质
B.反复煮沸的水不能饮用
C.可以用氯气对生活用水进行消毒
D.游览世博园时,多饮用纯净水对身体有益
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 8化学平衡移动练习卷(解析版) 题型:选择题
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
气体体积/L c(Y)/(mol·L-1) 温度/℃ | 1 | 2 | 3 |
100 | 1.00 | 0.75 | 0.53 |
200 | 1.20 | 0.90 | 0.63 |
300 | 1.30 | 1.00 | 0.70 |
下列说法正确的是( )
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减小
D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 7化学平衡状态的建立及标志练习卷(解析版) 题型:选择题
下列说法可以证明反应N2(g)+3H2(g) 2NH3(g)已达到平衡状态的是( )
2NH3(g)已达到平衡状态的是( )
A.1个N≡N键断裂的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.N2、H2、NH3的分子数之比为1∶3∶2
D.1个N≡N键断裂的同时,有6个H—N键形成
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 3燃烧热 能源练习卷(解析版) 题型:选择题
下列热化学方程式正确的是(ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g) 2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(燃烧热)
2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热)
NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热)
C.S(s)+O2(g) SO2(g) ΔH=-269.8 kJ·mol-1(反应热)
SO2(g) ΔH=-269.8 kJ·mol-1(反应热)
D.2NO2 O2+2NO ΔH=+116.2 kJ·mol-1(反应热)
O2+2NO ΔH=+116.2 kJ·mol-1(反应热)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com