
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的n(PCl3)随时间的变化如右图,下列说法正确的是
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的n(PCl3)随时间的变化如右图,下列说法正确的是
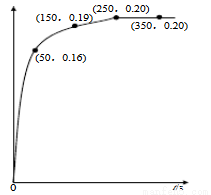
A.反应在前50 s 的平均速率v(PCl5)=0.0032 mol·L-1·s-1
B.该反应的平衡常数K= 0.025
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20molPCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D.保持其他条件不变,升高温度,平衡时:c(PCl3)=0.11mol·L-1,则反应的△H<0
科目:高中化学 来源:2015-2016学年山东省高一上学期第二次诊断性测试化学试卷(解析版) 题型:计算题
取7.8克的过氧化钠投入水中,完全反应后,所得溶液的体积为1L,问(1)生成的气体体积在标准状态下为多少升?(2)所得溶液溶质的物质的量浓度是多少?(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2016届江西省红色七校高三上学期第一次联考化学试卷(解析版) 题型:选择题
常温下pH=1的乙酸溶液和pH=13的NaOH溶液,下列叙述中正确的是
A.乙酸溶液中水的电离程度比NaOH溶液中的小
B.乙酸溶液中c(CH3COOH)大于NaOH溶液中c(Na+)
C.若两溶液混合后pH=7,则有:c(Na+)= c(CH3COOH) + c(CH3COO-)
D.分别稀释10倍,两溶液的pH之和大于14
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省临沂市高二上10月月考化学试卷(解析版) 题型:选择题
利用反应:2NO(g)+2CO(g)?2C02(g)+N2(g)△H=﹣746.8kJ•mol﹣1,可净化汽车尾气,如果要同时提高反应的速率和N0的转化率,采取的措施是
A.降低温度
B.增大压强
C.升高温度同时充入N2
D.及时将C02和N2从反应体系中移走
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上学期第一次月考化学试卷(解析版) 题型:填空题
(12分)有科学家正在研究用碳与一氧化氮反应处理环境问题:
C(s)+2NO(g)?CO2(g)+N2(g)△H
(1)实验方案中有下列措施①采用加热提高反应速率②使用催化剂提高反应速率③使用加压提高NO转化率④使CO2转化成干冰从体系用脱离,提高NO的转化率其中你认为可行的是 .(2分)
(2)这个反应的平衡常数表达式是 .(1分)
(3)在恒容恒温密闭容器中,科学家得到下列实验数据:
浓度(mol/L)
时间(min) NO N2 CO2
0 0.100 0 0
10 0.058 0.021 0.021
20 0.040 0.030 0.030
30 0.040 0.030 0.030
请求出该应在该温度下的平衡常数K= .(2分)
(4)若在(3)的实验中30min时开始升温,36min时达平衡,测得NO的转化率变为50%,则该反应的△H 0(1分)(填“>”、“<”、“=”),判断的理由是 .(2分)
(5)若科学家在30min后改变了某一条件,反应进行到40min时达平衡浓度分别为C(NO)=0.032mol/L,C(N2)=0.034mol/L,C(CO2)=0.017mol/L,则改变的条件可能是 ,(2分)判断的依据是 .(2分)
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期第二次月考理综化学试卷(解析版) 题型:填空题
【化学与技术】(15分)
从海水中提取一些重要的化工产品的工艺流程如图所示。

根据上述流程图回答下列问题:
(1)图中A的化学式为________________,(2分)在制取A的过程中需向饱和NaCl溶液中先后通入两种气体,后通入气体的化学式为_____________________。( 2分)
(2)海水淡化处理的方法有______________________________。(写出3种即可)( 3分)
(3)过程⑤的化学方程式为__________________________________________。( 2分)
(4)从B溶液制备B的无水晶体的“操作a”为_______________________________ 。( 2分)
(5)过程③用SO2水溶液吸收溴单质,吸收率可达93%,生成两种强酸,写出反应的离子方程式 _____________________________。( 2分)
(6)过程②到过程④的变化为“Br-→Br2→Br-→Br2”,其目的是____________。( 2分)
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中转移电子的物质的量为
A.0.4 mol B.0.5 mol C.0.6 mol D.0.8 mol
查看答案和解析>>
科目:高中化学 来源:2016届湖南省常德市高三上学期10月月考化学试卷(解析版) 题型:选择题
关于胶体和溶液的区别,下列叙述中正确的是
A.溶液呈电中性,胶体带有电荷
B.溶液中溶质微粒一定不带电,胶体中分散质微粒带有电荷
C.溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸
D.溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明亮的光带
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上学期第二次月考化学试卷(解析版) 题型:实验题
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
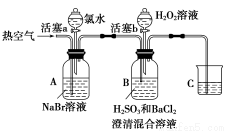
实验记录如下:
实验操作 | 实验现象 | |
Ⅰ | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为红棕色 |
Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
请回答下列问题:
(1)A中反应的离子方程式是______________________________。
(2)实验操作Ⅱ吹入热空气的目的是________________________。
(3)装置C的作用是______________,C中盛放的药品是______________________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式___________________。
(5)由上述实验得出的结论是______________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是__________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com