
| 甲 | 乙 | 丙 | 丁 | |
| 反应前质量/g | 64 | 10 | 1 | 25 |
| 反应后质量/g | 0 | 54 | 37 | 9 |
| A. | 1:2 | B. | 1:1 | C. | 2:1 | D. | 2:3 |
分析 根据质量守恒定律,由物质质量的增减可确定反应物和生成物;由增减量的多少可确定反应物和生成物的质量关系,再结合甲、丁的相对分子质量关系得出本题答案.
解答 解:根据质量守恒定律,由表中乙、丙质量增加,可确定乙、丙为生成物,共增加了(54-10)g+(37-1)g=80g,
丁减少了(25-9)g=16g,减少的质量还差(80-16)g=64g,由此可知64g甲完全反应无剩余.即甲、丁反应时的质量比为64g:16g=4:1.
设该反应的化学方程式中甲与丁的化学计量数的比为m:n,又知甲的相对分子质量为丁的2倍,则2m:n=4:1,解得m:n=2:1.
故选C.
点评 本题主要考查质量守恒定律,通过反应中物质的质量变化确定了反应物和生成物,再结合物质的相对分子质量关系,得出反应中物质的化学计量数之比,从而加深了对质量守恒定律的理解和应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
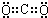
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 向碳酸氢钙溶液中加入过量氢氧化钠 Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| D. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++2SO42-+4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A. | 此反应为放热反应 | |
| B. | 此反应只有达到平衡时,密闭容器中的压强才不会变化 | |
| C. | 此反应达到1 000℃时的反应速率比700℃时大 | |
| D. | 该反应的化学平衡常数越大,反应物的转化率越低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加SO2的浓度,正反应速率先增大,后逐渐减小最后保持不变 | |
| B. | 增加O2的浓度,正反应速率逐渐增大 | |
| C. | 增加SO2的浓度,平衡常数增大 | |
| D. | 若平衡时SO2的浓度比原来大,则平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在放热反应中,旧键断裂需要的能量比新键形成放出的能量多 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 一个化学反应的能量变化只与反应物的用量有关,与各物质的状态无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LCCl4中含有分子的数目为0.5NA | |
| B. | 标准状况下,2.24LCl2通入水中生成NA个HClO | |
| C. | 1.6gO2与O3组成的混合物中所含O原子数为0.1NA | |
| D. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com