
| A. | 化学平衡是一个动态平衡 | |
| B. | 化学平衡研究的对象主要是可逆反应 | |
| C. | 化学反应速率是研究化学反应进行的快慢问题,化学平衡是研究化学反应进行的限度问题 | |
| D. | 化学反应达到平衡时,正反应和逆反应速率相等,是对反应中不同物质而言 |
分析 A.化学平衡是动态平衡,正逆反应速率相等但不等于0;
B.化学平衡研究的对象主要是可逆反应,不适用于不可逆反应;
C.化学反应速率体现化学反应进行的快慢,化学反应的限度体现化学平衡;
D.化学反应达到平衡时,正反应和逆反应速率相等,是对反应中同一物质而言.
解答 解:A.化学平衡是动态平衡,正逆反应速率相等但不等于0,所以处于动态平衡状态,故A正确;
B.化学平衡研究的对象主要是可逆反应,不适用于不可逆反应,可逆反应达到平衡状态时正逆反应速率相等,故B正确;
C.化学反应速率体现化学反应进行的快慢,化学反应限度体现化学平衡,所以化学反应速率是研究化学反应进行的快慢问题,化学平衡是研究化学反应进行的限度问题,故C正确,
D.化学反应达到平衡时,正反应和逆反应速率相等,是对反应中同一物质而言,不同物质之间的正逆反应速率可能相等,故D错误;
故选D.
点评 本题考查化学平衡、化学反应速率等知识点,为高频考点,明确化学平衡研究范围、平衡状态特点等知识点是解本题关键,易错选项是D.


科目:高中化学 来源: 题型:解答题

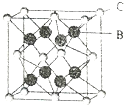
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
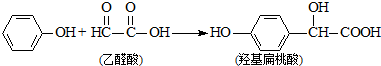
| A. | 该反应是加成反应 | B. | 苯酚和羟基扁桃酸是同系物 | ||
| C. | 该反应是取代反应 | D. | 乙醛酸不能与 NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 | B. | CrO3 | C. | Cr2(SO4)3 | D. | CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 20 | 40 |
| n(HI) | 1 | 0.91 | n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
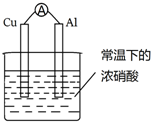
| A. | Cu是原电池的负极 | |
| B. | 电流由Cu电极流出 | |
| C. | 电子由Al沿导线流向Cu | |
| D. | 铝片上的电极反应式为:Al-3e-═Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 至少存在5种离子 | |
| B. | CO32-、Al3+一定不存在,K+可能存在 | |
| C. | SO42-、NH4+一定存在,Cl-可能不存在 | |
| D. | Cl-一定存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com