
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上常通过以下两步反应制备K2FeO4:
① 2FeCl3+10NaOH+3NaClO = 2Na2FeO4+9NaCl+5H2O
② Na2FeO4 + 2KOH == K2FeO4 + 2NaOH
下列说法不正确的是
A.反应①为氧化还原反应,反应②为复分解反应
B.反应①中NaClO 是氧化剂
C.Na2FeO4 中Fe为+4价,具有强氧化性,能杀菌消毒
D.若有2 mol FeCl3 发生反应,转移电子的物质的量为 6 mol
科目:高中化学 来源:2015-2016学年湖北武汉华中师大一附中高一上期中化学卷(解析版) 题型:实验题
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下(已知2KI+Cl2===2KCl+I2,碘与溴一样易溶于有机溶剂):
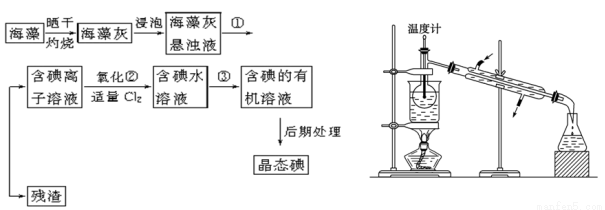
(1)指出提取碘的过程中有关的实验操作名称:①________,③________。
(2)提取碘的过程中,可供选择的有机试剂是________。
A.苯 B.四氯化碳 C.酒精 D.醋酸
(3)为使上述流程中含碘离子溶液转化为碘的有机溶液,实验室里有烧杯、玻璃棒以及必要的夹持仪器,尚缺少的玻璃仪器是 。
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图所示实验装置中的错误之处:
① 。
② 。
③ 。
(5)进行上述蒸馏操作时使用水浴的原因是 。
(6)四氯化碳是____色液体。如果本实验用苯做萃取剂,则上层液体的颜色为 色,下层液体中溶质的主要成分为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建厦门一中高一上期中考试化学试卷(解析版) 题型:实验题
用质量分数为98%密度为1.84g·cm-3的浓硫酸配制250mL物质的量浓度为2mol·L-1的稀硫酸。其操作步骤可分解为以下几步:
A.用量筒量取 mL浓硫酸, (简述浓硫酸稀释的操作),冷却
B.检查 (填所用仪器名称)是否漏水
C.用蒸馏水洗涤烧杯和玻璃棒2~3次,将每次的洗涤液都转移入容量瓶里
D.将稀释后的硫酸小心地用玻璃棒引流至容量瓶里
E.盖紧瓶塞,上下倒转摇匀溶液
F.将蒸馏水直接加入容量瓶至刻度线以下2cm处
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到凹液面最低点恰好与刻度线相切
请据此填写:
(1)完成上述步骤中的空白处。
(2)正确的操作顺序是(用字母填写):( )→( )→( )→( )→( )→( )→( )
(3)进行A步操作时,选用量筒的规格是 。(选填字母)
A.10mL B.50mL C.100mL D.1000mL
(4)下列情况对所配制的稀硫酸浓度有何影响?(选填“偏高”、“偏低”、“无影响”)。
①.用量筒量取浓硫酸时俯视,则 ;
②.A 步操作时,浓硫酸稀释后,未冷却即进行下一步操作,则_________;
③.定容时仰视溶液的凹液面,则_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建厦门一中高二上期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.常压下,正戊烷、异戊烷、新戊烷的沸点依次增大
B.按系统命名法,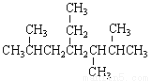 的名称为2,5,6-三甲基-4-乙基庚烷
的名称为2,5,6-三甲基-4-乙基庚烷
C.肌醇  与葡萄糖
与葡萄糖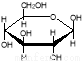 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物
的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物
D.1.0 mol的 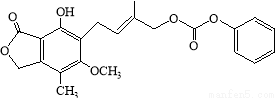 最多能与含5.0 molNaOH的水溶液完全反应
最多能与含5.0 molNaOH的水溶液完全反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建厦门一中高二上期中考试化学试卷(解析版) 题型:选择题
下图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是
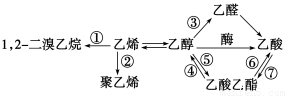
A.反应①是加成反应 B.只有反应②是加聚反应
C.只有反应⑦是取代反应 D.反应④⑤⑥是取代反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京顺义牛栏山一中高一上期中化学试卷(解析版) 题型:选择题
等质量的SO2和SO3 ,下列说法正确的是
A.所含氧原子的个数比为2∶3 B.所含硫原子的个数比为1∶1
C.所含氧元素的质量比为6∶5 D.所含硫元素的质量比为5∶4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽合肥第一六八中学高一上期中化学试卷(解析版) 题型:选择题
在标准状况下,一个充满Cl2的恒容密闭容器的质量为74.6 g,若改充满N2,其质量为66 g,则容器的容积为:
A.5.6L B.11.2L C.2.24L D.4.48L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上期中测试化学试卷(解析版) 题型:选择题
在恒温恒压下,a mol A和b mol B在一个容积可变的容器中发生反应:A(g)+2B(g) 2C(g),
2C(g),
一段时间后达到平衡,生成n mol C。则下列说法中正确的是
A.物质A、B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为(a+b)∶(a+b-0.5n)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡不移动
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光现代中学高一上12月月考化学卷(解析版) 题型:实验题
为了验证炭粉与浓硫酸作用确实有二氧化碳气体生成,某同学创设如下图所示的A、B、C三个装置进行实验,其中省略了课本上炭粉与浓硫酸反应的发生装置图。已知C中的KMnO4酸性溶液是足量的,具有强氧化性,还原性的SO2气体经过KMnO4酸性溶液后能全部被吸收氧化,据此,请回答下列问题。
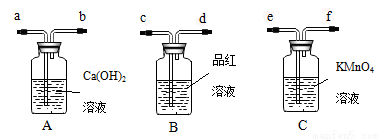
(1)炭粉与浓硫酸在加热条件下反应的化学方程式为_____________________
(2)由(1)产生的混合气体流经装置A、B、C的先后顺序是______、______、______(填A、B、C),气流依次经过装置管口顺序号为(填管口序号a、b、c、d、e、f);气体发生装置导管口接______,然后______接_____,______接_____;
(3)装置B的作用是__________________,装置B中观察到的现象是__________________;
(4)装置A中观察到的现象是_________________,得到的结论是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com