
用惰性电极电解下列溶液,一段时间后,加入一定质量的另一种物质(括号中),溶液能与原溶液完全相同的是
A.HBr(H2O) B.CuSO4(CuCO3)
C.AgNO3(AgNO3) D .NaHSO4(H2SO4)
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源:2016-2017学年山西省高二12月月考化学试卷(解析版) 题型:选择题
关于某酸的酸式盐NaHY的水溶液的下列叙述中,正确的是
A.该酸式盐的水溶液一定显酸性
B.在该盐溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C.若HY-能水解,水解方程式为:HY-+H2O Y2-+H3O+
Y2-+H3O+
D.若HY-能电离,电离方程式为:HY-+H2O Y2-+H3O+
Y2-+H3O+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高一期中化学卷(解析版) 题型:选择题
下列反应的现象描述与离子方程式 都正确的是
都正确的是
A.金属镁与稀硫酸反应:有氢气产生;Mg+2H++SO42? =MgSO4?+H2↑
B.氢氧化钡溶液与硫酸反应:有白色沉淀生成;Ba2+ +SO42-=BaSO4?
C.碳酸钙溶液与盐酸反应:有气泡生成;CaCO3+2H+=Ca2++CO2?+H2O
D.碳酸钙加入醋酸:有气体生成;CaCO3+2H+=CO2↑+ Ca2+ +H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:填空题
在实验室模拟工业上以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验
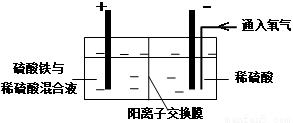
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
① 阳极区硫酸铁的主要作用是 _____________。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是_____________。(使用化学用语作答)
(2)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 _____________;加入有机萃取剂的目的是___________________。
(3)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 _____________。
(4)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ___________________。(忽略电解前后溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:选择题
在容积均为500ml的I、II、III三个密闭容器中分别充入l molN2和2.5 molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下发生反应N2(g)+3H2(g)  2NH3(△H<0)。实验测得反应均进行到t min时N2的体积分数如图所示。下列说法正确的是
2NH3(△H<0)。实验测得反应均进行到t min时N2的体积分数如图所示。下列说法正确的是
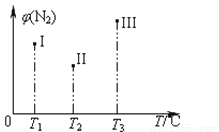
A.当v(H2)=3v(N2)时,可以说明三个容器中的反应达平衡状态
B.在t min时,一定达化学平衡状态的是Ⅱ和Ⅲ
C.在t min时,测得c(N2)=1mol/L;若在向III中充入1.5molN2和1molNH3,H2的转化率不变
D.三个容器中的反应均达到平衡后,容器I中混合气体的平均相对分子质量最小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二11月月考化学试卷(解析版) 题型:实验题
研究硫元素及其化合物的性质具有重要意义。
I.利用下图装置模拟工业生产中SO2催化氧化的反应并研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)
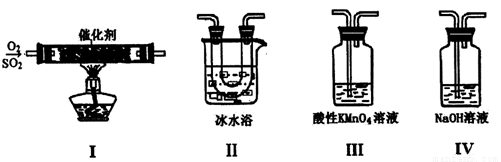
(1)甲同学按I、II、III、IV的顺序连接装置,装置II的作用是_________;装置III中溶液逐渐褪色,证明二氧化硫具有___________性。
(2)乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置(装置Ⅱ中充分冷却),若装置Ⅳ中有40 mL 3.0mol/L NaOH溶液,反应后增重5.12 g,则装置Ⅳ中发生反应的化学方程式是_______________。
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管中,未见沉淀生成。向该试管中加入足量________(填字母),便能产生沉淀。
A.硫化钠溶液 B.氨水 C.盐酸 D.硝酸钾溶液
Ⅱ.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
称取铁钉(碳素钢)6g放入15mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
(4)甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+应选用________(填序号)。
a.KSCN溶液和氯水 b.氢氧化钠溶液
c.酸性KMnO4溶液 d.铁粉和KSCN溶液
(5)乙同学取784mL(标准状况)气体Y通入足量H2O2水溶液中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积百分数为____________。(保留小数点后一位)
(6)分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和CO2气体,产生CO2的理由是_______________(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二11月月考化学试卷(解析版) 题型:选择题
短周期元素X和元素Y,元素X原子的最外层电子数为a,次外层电子数为b;元素Y原子的M层电子数为(a-b),L层电子数为(a+b),则X、Y两元素形成的化合物可能具有的性质是( )
A. 和水反应 B. 和硫酸反应 C. 和氢氧化钠反应 D. 和氯气反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省钦州港区高一上11月月考化学卷(解析版) 题型:选择题
ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒,我国最近成功研 制出制取ClO2的新方法,其反应的微观过程如下所示:
制出制取ClO2的新方法,其反应的微观过程如下所示:
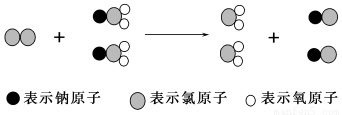
下列有关该反应的叙述中正确的是( )
A.该反应是复分解反应
B.该反应的化学方程式为Cl2+2NaClO2===2ClO2+2NaCl
C.反应中Cl2既是氧化剂,又是还原剂
D.生成2 mol ClO2时转移的电子数为6 mol
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期期中化学试卷(解析版) 题型:选择题
下列反应所产生的气体体积在标准状况下为22.4L的是
A.将2mol金属Cu与含2molH2SO4的浓硫酸共热
B.将1 mol MnO2固体与含4molHCl的浓盐酸共热
C.常温下,将32.2g金属钠和5.4g金属铝同时投入到足量水中
D.常温下,将10.8g的Al和22.4g的Fe投入到300g 98%的硫酸中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com