

分析 (1)①根据化合价降低为氧化剂被还原判断;根据傅里叶红外光谱图(如图2所示)确定化合物X含硝酸根;
②根据NOx与NH3的直接反应,实现无害转化,则生成氮气和水,据此书写方程式;
(2)①根据次氯酸钠氧化废水中NH4+ 完全转化为N2,而本身被还原为NaCl结合得失电子守恒配平方程式;
②根据反应的离子方程式进行计算;
(3)由装置如图3所示,左边为阳极为CN-失电子生成氮气的反应,右边为阴极为氢离子得电子生成氢气的反应,据此分析;
解答 解:(1)①在图1所示的转化中N、O化合价降低为氧化剂被还原;由傅里叶红外光谱图(如图2所示)确定化合物X含硝酸根,再结合图一由钡离子参与,所以X为Ba(NO3)2;故答案为:N、O;Ba(NO3)2;
②因为NOx与NH3的直接反应,实现无害转化,则生成氮气和水,所以当NO与NO2的物质的量之比为4:1时,发生反应的化学方程式为8NH3+8NO+2NO2=9N2+12H2O,
故答案为:8NH3+8NO+2NO2=9N2+12H2O;
(2)①因为次氯酸钠氧化废水中NH4+ 完全转化为N2,而本身被还原为NaCl,根据得失电子守恒,离子方程式为2NH4++3ClO-=N2↑+3Cl-+2H++3H2O,
故答案为:2NH4++3ClO-=N2↑+3Cl-+2H++3H2O;
②由2NH4++3ClO-=N2↑+3Cl-+2H++3H2O得,处理废水产生了0.448L即$\frac{0.448L}{22.4L/mol}$=0.02mol N2(标准状况),则需消耗浓度为0.5mol•L-1的次氯酸钠的体积为$\frac{0.02×3}{0.5}$×1000ml=120ml,故答案为:120;
(3)由装置如图3所示,左边为阳极为CN-失电子生成氮气的反应,又溶液成碱性,所以反应式为:2CN-+12OH--10e-=2CO32-+N2↑+6H2O;右边为阴极为氢离子得电子生成氢气的反应,所以甲为氢气,
故答案为:H2;2CN-+12OH--10e-=2CO32-+N2↑+6H2O.
点评 本题重点考查了氧化还原反应以及电解池的原理,从深层次的理解氧化还原反应的本质是解决本题的关键,难度不大,注意化合价降低为氧化剂被还原,化合价升高为还原剂被氧化;


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:填空题
| 硼镁矿 | 硼砂 | 硼酸 | 偏硼酸钠 |
| Mg2B2O5•H2O | Na2B4O7•10H2O | H3BO3 | NaBO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中通入过量CO2:2OH-+CO2=CO32-+H2O | |
| B. | 电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 向H2O2溶液中加入MnO2:2H2O2+4H++MnO2=O2↑+Mn2++4H2O | |
| D. | 向KAl(SO4)2溶液中滴加Ba(OH)2溶液至SO42-沉淀完全:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢是用量最大,用途最广的合金 | |
| B. | 苯酚沾到皮肤上,应立即用大量的热水冲洗 | |
| C. | 利用高纯单质硅,可以制成光电池 | |
| D. | 含氯,溴的氟代烷可对臭氧层产生破坏作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水、氯水、氨水均为混合物 | |
| B. | SiO2不能和水反应,所以它不是酸性氧化物 | |
| C. | 液氨、液态氯化氢都是非电解质 | |
| D. | 冰、干冰、冰醋酸都是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 结论 |
| A | 将二氧化硫通入溴水中,溴水褪色 | 二氧化硫有漂白性 |
| B | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 | 随溶液pH减小,“84”消毒液氧化能力增强 |
| C | 铜放入稀硫酸中,无明显现象,再加入硝酸钠固体,溶液变蓝,有明显气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸反应速率 |
| D | 淀粉与稀硫酸共热,再加银氨溶液水浴加热,无银镜生成 | 淀粉没有水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
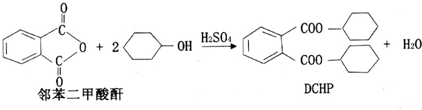
| A. | DCHP的分子式为C20H28O4 | |
| B. | 上述制备DCHP的反应属于取代反应 | |
| C. | DCHP苯环上的一氯代物有4种 | |
| D. | 1 mol DCHP最多可与含4 mol NaOH的溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com