
【题目】学习化学有利于我们认识饮食与健康的关系,养成良好的饮食习惯.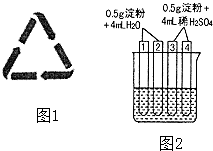
(1)油脂被摄人人体后,在酶的作用下水解为(写名称,下同)和 , 进而被氧化生成并提供能量,或作为合成人体所需其他物质的原料.
(2)发育出现障碍,患营养缺乏症,这主要是由于摄取(填“蛋白质”、“脂肪”或“糖类”)不足引起的.下列食物中富含该物质的是 (填字母).
A菠菜 B花生油 C瘦肉 D西瓜
(3)某火腿制品的包装上印有相关配料:精选瘦肉、白糖、淀粉、亚硝酸钠等.火腿中属于防腐剂的是 , 不可长期或大量进食腌制肉类食品的原因是:其包装袋上常可看到如图1所示的图标,它的含义是 , 此包装袋材料是聚乙烯塑料,它的单体是(填结构简式).
(4)如图2所示4支试管同时水浴加热4min.为检验其中淀粉的水解程度,某同学的实验操
作与现象记录如下:
试管 | 操作 | 现象 |
① | 加入碘水 | 溶液变成蓝色 |
② | 加入银氨溶液,水浴加热 | 未出现银镜 |
③ | 加入碘水 | 溶液变成蓝色 |
④ | 加入银氨溶液,水浴加热 | 未出现银镜 |
①结合试管1、2中的现象,得出的结论是:这两支试管中淀粉水解(填“没有”、“部分”或“全部”),淀粉 (填“有”或“没有”)还原性.
②结合试管3、4中的现象,(填“能”或“不能”)得出“这两支试管中淀粉没有水解”的结论,理由是 .
【答案】
(1)高级脂肪酸;甘油;二氧化碳、水
(2)蛋白质;C
(3)亚硝酸钠;亚硝酸钠与肉类的蛋白质反应,生成一种致癌物;可回收物;CH2=CH2
(4)没有;没有;不能;银镜反应须在碱性环境中进行,未用NaOH溶液中和硫酸.
【解析】(1)油脂在酶的催化作用下,水解生成高级脂肪酸和甘油,进而被氧化生成二氧化碳、水为人体提供热量,或作为合成人体所需其他物质的原料,
(2)发育出现障碍,患营养缺乏症,这主要是由于摄入蛋白质不足引起的,瘦肉中富含蛋白质,菠菜和西瓜中富含维生素,花生油中富含油脂,
(3)亚硝酸钠常作为肉制品的防腐剂和着色剂,亚硝酸钠与肉类的蛋白质反应,生成一种致癌物亚硝胺,图1的标志为可回收物,聚乙烯塑料的单体是乙烯,
(4)①试管1中现象,淀粉遇碘变蓝色,说明试管1中含有淀粉,葡萄糖与银氨溶液发生银镜反应,试管2中现象说明没有葡萄糖生成,说明淀粉没有发生水解,淀粉没有还原性,不能被银氨溶液氧化,②试管3中加入碘水,溶液变成蓝色,说明试管3中含有淀粉,淀粉在酸性条件下发生水解,葡萄糖在碱性环境中与银氨溶液发生银镜反应,未用NaOH溶液中和硫酸,所以试管4未出现银镜,因此不能得出“这两支试管中淀粉没有水解”的结论,


科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题小组以此粉末为原料,设计资源回收的工艺流程如下:
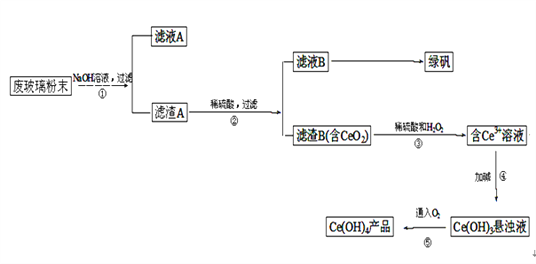
(1)写出第①步反应的离子方程式___________________________________________。
(2)洗涤滤渣B的目的是为了除去______(填离子符号),
(3)写出第③步反应的化学方程式_________________________。
(4)制备绿矾(FeSO4·7H2O)时,向Fe2(SO4)3溶液中加入过量_______,(物质名称)充分反应后,经过滤得到FeSO4溶液,再经________、________、过滤、洗涤、干燥等操作步骤得到绿矾。
(5)取上述流程中得到的Ce(OH)4产品(质量分数为80%)1.300g,加硫酸溶解后,用 0.1000mol/L FeSO4溶液滴定至终点(铈被还原成Ce3+),则需准确滴加标准溶液的体积为________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,化合物M对番茄灰霉菌有较好的抑菌活性,其合成路线如下图所示。


完成下列填空:
(1)写出反应类型。
反应③___________ 反应④__________
(2)写出结构简式。
A______________ E_______________________
(3)写出反应②的化学方程式________________
(4)B的含苯环结构的同分异构体中,有一类能发生碱性水解,写出检验这类同分异构体中的官能团(酚羟基除外)的试剂及出现的现象。
试剂(酚酞除外)___________ 现象________________________
(5)写出两种C的含苯环结构且只含4种不同化学环境氢原子的同分异构体的结构简式。_____________
(6)反应①、反应②的先后次序不能颠倒,解释原因。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
(1)该反应的平衡常数表达式K= .
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验.
实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如表:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL 18molL﹣1浓H2SO4 | 饱和Na2CO3溶液 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 | |
C | 3mL乙醇、2mL乙酸、6mL 3molL﹣1 H2SO4 | 1.2 | |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是mL和molL﹣1 .
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性,提高了乙酸乙酯的产率.浓H2SO4的吸水性能够提高乙酸乙酯产率的原因是 .
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要减轻大气污染,必须加强对工业废气和汽车尾气等的治理.根据所学知识回答下列问题:
(1)控制燃煤产生的SO2排放,能够减少型酸雨的形成.燃煤排放的烟气中还古有其他大气污染物,请列举两种: .
(2)煤的气化和液化是实现能源清洁化的重要途径.将焦炭在高温下与水蒸气反应,得到CO和H2 , 就是煤的气化过程,该反应的化学方程式为 .
(3)在汽车尾气排放口加装“三效催化净化器”,在催化剂的作用下,可将尾气中的CO、NO转化为空气中的两种无毒气体,该反应的化学方程式为 .
(4)室内空气污染物包括CO、C02、甲醛、苯等,在这四种污染物中,由家用燃料燃烧产生的是;由建筑和装修产生的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZnO在医药、石化等领域有广泛的用途。研究小组用某闪锌矿(主要成分ZnS,含有FeS、SiO2、MnCO3等杂质)制备氧化锌和硫单质,设计如下流程:

请回答下列问题:
(1)滤渣1的化学式为_______,
(2)沉淀X的化学式为______________。
(3)“转化Ⅱ”中主要反应的离子方程式为___________________________。
(4)“一系列操作”包括过滤、洗涤、干燥。洗涤沉淀的操作为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36 g·cm-3。实验室制备少量1-溴丙烷的主要步骤如下:
步骤1:在仪器A中加入搅拌磁子、12 g正丙醇及20 mL水,冰水冷却下缓慢加入28 mL浓H2SO4;冷却至室温,搅拌下加入24 g NaBr。
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12 mL H2O、12 mL 5% Na2CO3溶液和12 mL H2O洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。

(1)仪器A的名称是_____________;加入搅拌磁子的目的是防止暴沸和___________________。
(2)反应时生成的主要有机副产物有2-溴丙烷和__________________________________。
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是___________________。
(4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是______________________________。
(5)步骤4中用5%Na2CO3溶液洗涤有机相的操作: 向分液漏斗中小心加入12 mL 5% Na2CO3溶液,振荡,____________,静置,分液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水提取溴和镁的过程如下,下列说法不正确的是( )
A.若提取1 mol Br2 , 至少需要标准状况下44.8 L的Cl2
B.工业上常利用电解熔融MgCl2冶炼金属镁
C.富集溴元素过程中,空气吹出法利用了溴易挥发的性质
D.工业溴中含少量Cl2 , 可用NaOH溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿(主要成份为FeO·Cr2O3,还含有Al2O3、MgO等杂质)为主要原料生产二水合重铬酸钠(Na2Cr2O7·2H2O),其主要工艺流程如下图所示。

回答下列问题:
(1)二水合重铬酸钠(Na2Cr2O7·2H2O)中Cr的化合价为________________。
(2)已知:步骤①中涉及的主要反应是FeO·Cr2O3+Na2CO3+O2![]() Na2CrO4+Fe2O3+CO3(未配平),该反应中氧化剂和还原剂的物质的量比为_____________。
Na2CrO4+Fe2O3+CO3(未配平),该反应中氧化剂和还原剂的物质的量比为_____________。
(3)滤渣1的主要成分为MgO和_____(填化学式);滤渣2的成分是______(填物质名称)。
(4)步骤④,向滤液中加入稀硫酸,溶液由黄色变为橙色,得到Na2Cr2O7和Na2SO4的混合溶液,发生反应的离子方程式为_______________。
(5)经步骤④酸化后的溶液中获得Na2Cr2O7·2H2O晶体的操作依次是蒸发浓缩、____、过滤、洗涤、干燥。
(6)该工艺的酸性废液中含有Cr2O72-,可向废液中加入绿矾(FeSO4·7H2O)还原处理。若处理20m3的Cr2O72-酸性废液,需要绿矾166.8g,则原废液中Cr2O72-的物质的量浓度为_____mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com