
【题目】按要求回答下列问题:
(1)2,3—二乙基—1,3—戊二烯用H2完全加成后产物的名称:_________________________
(2)组成为C3H6Br2的卤代烃,同分异构体有_________种
(3)碳原子数小于10的烷烃中,一氯取代物没有同分异构体的烷烃共有_________种
(4)C4H10O的同分异构体中,属于醇类且含有“手性碳原子”的结构简式为__________。
(5)实验室制取乙炔的化学方程式:_______________________________________
(6)2—甲基—1,3—丁二烯加聚反应方程式:________________________________
(7)甲苯制取TNT的化学方程式:____________________________________________
(8)等物质的量的甲烷、乙烯、乙炔、苯等四种有机物分别完全燃烧,需要O2最多的是__;等质量的上述四种物质分别完全燃烧,需要O2最多的是____。
(9)写出间甲基苯乙烯的结构简式______________________________;
(10)与H2加成生成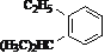 的炔烃的结构简式____________;
的炔烃的结构简式____________;
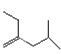
(11)写出4-甲基-2-乙基-1-戊烯的键线式__________________________。
【答案】3—甲基—4—乙基已烷 4 4 CH3CH2CH(OH)CH3 CaC2+2H2O=Ca(OH)2+C2H2↑ n![]()
![]()
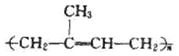
![]() +3HO-NO2
+3HO-NO2 ![]()
![]() +H2O 苯 甲烷
+H2O 苯 甲烷 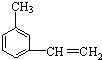
【解析】
(1)2,3—二乙基—1,3—戊二烯用H2完全加成后二烯烃生成烷烃,烷烃的碳键最长的为6个碳,产物的名称为:3—甲基—4—乙基已烷;
(2)组成为C3H6Br2的卤代烃,同分异构体有1,1-二溴丙烷、2,2-二溴丙烷、1,2-二溴丙烷、1,3-二溴丙烷共4种;
(3)碳原子数小于10的烷烃中,一氯取代物没有同分异构体的烷烃有甲烷、乙烷、2,2-二甲基丙烷、2,2,3,3-四甲基丁烷共4种;
(4)C4H10O的同分异构体中属于醇类的有多种,其中具有手性碳原子的同分异构体的结构简式为:CH3CH2CH(OH)CH3;
(5)实验室利用电石与水反应制取乙炔,反应的化学方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑;
(6)2—甲基—1,3—丁二烯加聚反应方程式:n![]()
![]()
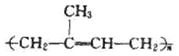 ;
;
(7)甲苯与浓硝酸反应制取TNT,反应的化学方程式为:![]() +3HO-NO2
+3HO-NO2 ![]()
![]() +H2O;
+H2O;
(8)(1)等物质的量的四种有机物,分别在氧气中完全燃烧,1mol物质耗氧量为:
1mol甲烷CH4耗氧量为2mol;
1mol乙烯C2H4耗氧量为3mol;
1mol乙炔C2H2耗氧量为2.5mol,
1mol苯C6H6耗氧量为7.5mol,故耗氧量最多的是苯;
等质量的上述四种有机物完全燃烧耗氧量取决于H元素的含量,H元素含量越高,耗氧量越多,根据CxHy中![]() 值判断,该值越大耗氧量越多:甲烷CH4,乙烯C2H4最简式为为CH2,乙炔C2H2最简式为为CH,苯C6H6的最简式为CH,甲烷中H元素质量分数最大,所以甲烷CH4耗氧量最大,故答案为:苯;甲烷;
值判断,该值越大耗氧量越多:甲烷CH4,乙烯C2H4最简式为为CH2,乙炔C2H2最简式为为CH,苯C6H6的最简式为CH,甲烷中H元素质量分数最大,所以甲烷CH4耗氧量最大,故答案为:苯;甲烷;
(9)间甲基苯乙烯,该有机物的苯环上乙烯基的间位含有一个甲基,该有机物结构简式为: ;
;
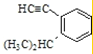
(10) 的侧链添加碳碳三键,只有一种添加方法,得到的有机物的结构简式为:
的侧链添加碳碳三键,只有一种添加方法,得到的有机物的结构简式为: ;
;
(11)4-甲基-2-乙基-1-戊烯的键线式为 。
。


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】英国科学家希尔发现,离体的叶绿体悬浮液中加入适当的电子受体(如草酸铁),在光照时可使水分解而释放氧气,从而证明了氧的释放与CO2还原是不同的过程,将对光合作用的研究上升到细胞层面。该反应方程式为4Fe3++2H2O![]() 4Fe2++4H++O2↑,下列有关希尔反应说法错误的是( )
4Fe2++4H++O2↑,下列有关希尔反应说法错误的是( )
A. 水在光反应中起供氢体和电子供体双重作用
B. 反应后溶液pH减小
C. 生成标准状况下11.2 L O2时,Fe3+得电子数为2NA
D. 叶绿体本身被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____,基态As原子核外有_________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____和+3。砷的电负性比镍____(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是___________________________________________。
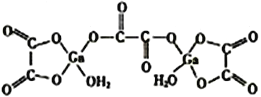
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______________。
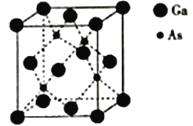
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_________,晶体的密度为___________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3)和铝矿渣(主要含Al2O3和SiO2)制备七铝十二钙的工艺如下:
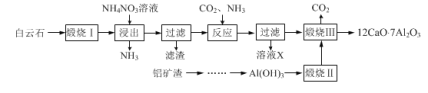
已知“煅烧Ⅲ”时发生反应为:12CaCO3+7Al2O3![]() 12CaO·7Al2O3+12CO2↑
12CaO·7Al2O3+12CO2↑
(1)写出“浸出”过程中CaO与NH4NO3溶液反应的化学方程式:___。
(2)检验“浸出”过程中有NH3生成的方法是:___。
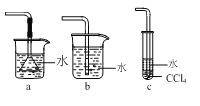
(3)如图所示装置中可用于实验室吸收NH3的是___(填字母)。
(4)溶液X中所含主要溶质的化学式为____。
(5)设计由铝矿渣制取Al(OH)3的方法,并简述过程:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用废旧电池的铜帽(铜锌总含量约99%)制备了CuSO4·5H2O样品,制备流程如下:
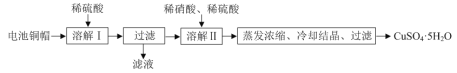
(1)“溶解Ⅱ”过程中,发生反应的离子方程式为___。
(2)“溶解Ⅱ”过程中应控制反应温度,温度不能过高的原因是___。
(3)为测定所得CuSO4·5H2O样品的纯度,兴趣小组进行了如下实验:称取2.540g样品,配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量KI并充分振荡后,滴加几滴淀粉溶液,再滴入0.0400mol·L-1的Na2S2O3溶液至刚好完全反应,恰好完全反应时消耗Na2S2O3溶液的体积为25.00 mL。实验过程中发生的反应如下:2Cu2++4I-=2CuI↓+I2、2S2O32-+I2=S4O62-+2I-
①配制250mL溶液所需的玻璃仪器除烧杯、胶头滴管外还有___。
②计算出样品中CuSO4·5H2O的质量分数。___(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的摩尔体积比乙的摩尔体积小
C.甲的相对分子质量比乙的相对分子质量小
D.甲的物质的量比乙的物质的量少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图实验室某浓盐酸试剂瓶标签上的有关数据,下列说法正确的是

A. 该浓盐酸中HCl的物质的量浓度为11.9mol·L-1
B. 溶液中HCl的物质的量不随所取体积的多少而变化
C. 配制500 mL0.400 mol·L-1的稀盐酸需要量取浓盐酸1.68mL
D. 中和含0.4 g NaOH的NaOH溶液需取0.400 mol·L-1的稀盐酸2.5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“毒鼠强”是一种灭鼠药,具有极强的毒性,国家已禁止使用。它是一种含有C、H、O、N、S的有机物,其摩尔质量为240![]() ;其中所含碳元素的质量分数为20%,所含氢元素的质量分数为3.0%,所含氧元素的质量分数为28%,其余为N、S。
;其中所含碳元素的质量分数为20%,所含氢元素的质量分数为3.0%,所含氧元素的质量分数为28%,其余为N、S。
(1)误食0.1g “毒鼠强”就可以使人死亡,0.1g “毒鼠强”的物质的量为_______?
(2)试求“毒鼠强”中C、H、O三种元素的原子个数比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-环乙二醇可通过下列路线合成(某些反应的反应物和反应条件未列出):
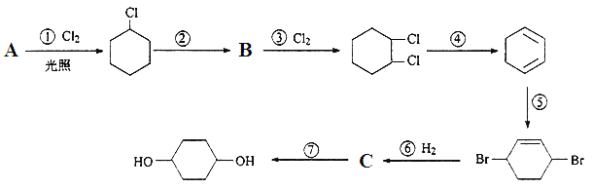
1,4-环乙二醇
(1)A的结构简式是___________________________。
(2)反应②应所需的试剂和条件是_______________________________。
(3)写出反应④、⑦的化学方程式:
④____________________________________________;
⑦_________________________________________。
(4)①的反应类型是_________,②的反应类型是_________,上述七个反应中属于加成反应的有_________(填反应序号),
(5)反应⑤中可能产生一定量的有机副产物,其可能的结构简式为________________________。(写出一种即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com