
分析 (1)铝与盐酸反应生成氯化铝与氢气,镁与盐酸反应生成氯化镁与氢气;
令合金中Mg、Al的物质的量分别为xmol、ymol,用x、y表示出各自生成的氢气,利用二者质量之和为3.9g,列方程可以计算出x、y的值,可以测量测定出镁的质量分数.
(2)铝与氢氧化钠反应溶解,镁不能与氢氧化钠反应,故可以加入氢氧化钠溶液,剩余的固体为Mg,Mg的质量除以总质量可得合金中Mg的质量分数.
(3)由转化关系可知,最后的沉淀是氢氧化镁,分离固体与溶液常用的分离方法是过滤;
根据氢氧化镁的质量计算合金中Mg的质量,再利用质量分数的定义计算合金中Mg的质量分数;
未洗涤沉淀,氢氧化镁沉淀附着其它物质,使测定的氢氧化镁的质量增大,导致测定合金中Mg的质量增大.
解答 解:(1)铝与盐酸反应生成氯化铝与氢气,反应离子方程式为2Al+6H+═2Al3++3H2↑,镁与盐酸反应生成氯化镁与氢气,反应离子方程式为Mg+2H+═Mg2++H2↑;
令合金中Mg、Al的物质的量分别为xmol、ymol,用x、y表示出各自生成的氢气,利用二者质量之和为3.9g,列方程可以计算出x、y的值,可以测量测定出镁的质量分数,
故答案为:2Al+6H+═2Al3++3H2↑、Mg+2H+═Mg2++H2↑;能;
(2)铝与氢氧化钠反应溶解,镁不能与氢氧化钠反应,故可以加入氢氧化钠溶液,剩余的固体为Mg,故得合金中Mg的质量分数为$\frac{ag}{3.9g}$×100%=$\frac{100a}{3.9}$%,
故答案为:NaOH溶液;$\frac{100a}{3.9}$%;
(3)由转化关系可知,最后的沉淀是氢氧化镁,分离固体与溶液常用的分离方法是过滤;
氢氧化镁的质量是2.9g,根据镁元素守恒可知合金中Mg的质量为2.9g×$\frac{24}{58}$=1.2g,所以合金中Mg的质量分数为$\frac{1.2g}{3.9g}$×100%=30.8%;
未洗涤沉淀,氢氧化镁沉淀附着其它物质,使测定的氢氧化镁的质量增大,导致测定合金中Mg的质量增大,测定的合金中镁的质量分数偏大,
故答案为:过滤;30.8%;偏大.
点评 本题考查镁和铝的化学性质、化学实验方案的设计,物质含量测定、化学计算等,难度中等,掌握镁和铝的化学性质是解题的关键.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
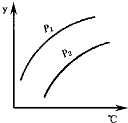 如图表示不同温度和压强下,对可逆反应2L(气)?2M(气)+N(气)△H>0平衡状态的影响(p1<p2),图中y轴表示的意义是( )
如图表示不同温度和压强下,对可逆反应2L(气)?2M(气)+N(气)△H>0平衡状态的影响(p1<p2),图中y轴表示的意义是( )| A. | 一定条件下L的转化率 | B. | 气体混合物的平均摩尔质量 | ||
| C. | 气体混合物中L的体积分数 | D. | 气体L的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
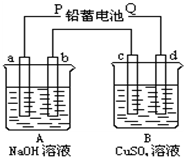 用如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).
用如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42-、CO32-、F- | B. | CO32-、SO42-、F- | C. | CO32-、F-、SO42- | D. | F-、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 碳酸钠溶液可用于治疗胃病 | Na2CO3可与盐酸反应 | Ⅰ对,Ⅱ对,有 |
| B | 向Na2O2的水溶液中滴入酚酞变红色 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠保存在煤油中,以隔绝空气 | 常温下,金属钠在空气中会生成过氧化钠 | Ⅰ对,Ⅱ对,有 |
| D | 过氧化钠可用于航天员的供氧剂 | Na2O2能和CO2和H2O反应生成O2 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质(括号内为杂质) | 所用试剂 | 主要实验操作 | |
| A | H2O(H2O2) | MnO2 | 过滤 |
| B | CaCl2(NaCl) | 适量Na2CO3溶液 | 沉淀、过滤、蒸发、结晶 |
| C | CO2(CO) | 过量O2 | 点燃 |
| D | Al(Al2O3) | 足量稀H2SO4 | 溶解、过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com