
分析 (1)浓硫酸的物质的量浓度为c=$\frac{1000ρw}{M}$,然后根据溶液稀释定律C浓V浓=C稀V稀来计算;
(2)根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;
(4)根据移液的操作方法来分析;
(5)定容时,要用胶头滴管来滴加;
(6)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:(1)先计算出浓硫酸的物质的量浓度为c=$\frac{1000ρw}{M}$=$\frac{1000×1.84g/ml×98%}{98g/mol}$=18.4mol/L,
设需要的浓硫酸的体积为Vml,根据溶液稀释定律C浓V浓=C稀V稀可知:
18.4mol/L×VmL=0.5mol/L×500mL
解得V=13.6mL,故答案为:13.6;
(2)需要的浓硫酸的体积为13.6ml,根据“大而近”的原则,故选择20ml的量筒,故答案为:20;
(4)移液时,是将冷却至室温的上述溶液沿玻璃棒注入500ml容量瓶中,
故答案为:玻璃棒;500容量瓶;
(5)定容时,开始时直接向容量瓶中加水,加水至距刻度线1-2cm时,改用胶头滴管逐滴加入,使溶液凹液面跟刻度相平,
故答案为:1-2cm;
(6)①定容时,观察液面俯视,会导致溶液体积偏小,则浓度偏高,故答案为:偏高;
②摇匀后,液面低于刻度线是正常的,没有再加水正确的,故答案为:无影响.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,题目难度不大.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:解答题
 国际化学年的中国宣传口号是“化学--我们的生活,我们的未来”.学习化学应该明白“从生活中来,到生活中去”道理.请填空:
国际化学年的中国宣传口号是“化学--我们的生活,我们的未来”.学习化学应该明白“从生活中来,到生活中去”道理.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:1:6 | B. | 3:1:2 | C. | 3:2:2 | D. | 9:2:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含金属元素的离子不一定都是阳离子 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 化合物变为单质时,化合价变化的元素一定被还原 | |
| D. | 油锅着火时,立即用水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2为0.2mol/L,H2为0.6mol/L | B. | N2为0.15mol/L | ||
| C. | N2、H2均为0.18mol/L | D. | NH3为0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
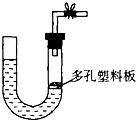 如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )
如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )| A. | 大理石和稀硫酸制取二氧化碳 | B. | 锌粒和稀硫酸制氢气 | ||
| C. | 块状碳酸钠和稀盐酸制取二氧化碳 | D. | 氯酸钾和二氧化锰制氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
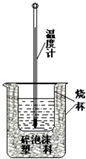 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.0 | 3.0 |
| 2 | 25.1 | 25.1 | 25.1 | 28.2 | 3.1 |
| 3 | 25.1 | 25.1 | 25.1 | 28.3 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素性质或原子结构 |
| T | 单质是一种淡黄色固体,是黑火药成分之一 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
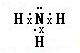 ,其水溶液呈碱性的原因是(用电离方程式表示):NH3•H2O?NH4++OH-.
,其水溶液呈碱性的原因是(用电离方程式表示):NH3•H2O?NH4++OH-.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com