
| 溶质 | Na2CO3 | NaClO | NaHCO3 | CH3COONa | NaHSO3 |
| pH | 11.6 | 10.3 | 9.7 | 8.8 | 5.2 |
| A. | 少量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO-=2H++Cl-+SO42- | |
| B. | 常温下,稀释CH3COOH或HClO溶液时,溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$不变(HR代表CH3COOH或HClO) | |
| C. | 等体积、等物质的量浓度的Na2CO3、CH3COONa、NaHSO3三种溶液混合,溶液中:c(HSO3-)>c(CH3COO-)>c(CO32-) | |
| D. | 含等物质的量的NaHCO3和CH3COONa的混合液中:c(OH-)-c(H+)=c(H2CO3)+c(CH3COOH) |
分析 A.次氯酸根离子具有强氧化性,能够将二氧化硫氧化成硫酸根离子,但氢离子与次氯酸根离子结合生成次氯酸;
B.$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$的分子、分母同时乘以氢离子浓度后再进行分析;
C.亚硫酸氢钠与碳酸钠反应生成碳酸氢钠和亚硫酸钠,则溶液中硫酸氢根离子、碳酸根离子浓度远远小于醋酸根离子;
D.根据混合液中的电荷守恒、物料守恒分析.
解答 解:A.少量SO2通入NaClO溶液中,NaClO过量,反应生成次氯酸、硫酸根离子和氯离子,正确的离子方程式为:H2O+SO2+3ClO-=2HClO+Cl-+SO42-,故A错误;
B.$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$的分子、分母同时乘以c(H+)可得:$\frac{c({R}^{-})•c({H}^{+})}{c(HR)•c(O{H}^{-})•c({H}^{+})}$=$\frac{{K}_{a}}{{K}_{W}}$,由于电离平衡常数和水的离子积都不变,所以该比值不变,故B正确;
C.等体积、等物质的量浓度的Na2CO3、CH3COONa、NaHSO3三种溶液混合,Na2CO3、NaHSO3反应生成Na2SO3、NaHCO3,则溶液中的HSO3-、CO32-浓度远远小于CH3COO-,故C错误;
D.等物质的量的NaHCO3和CH3COONa的混合液中,根据电荷守恒可得:①c(OH-)+c(HCO3-)+c(CH3COO-)+2c(CO32-)=c(H+)+c(Na+),根据物料守恒可得:②c(H2CO3)+c(CH3COOH)+c(HCO3-)+c(CO32-)=c(Na+),将②带入①可得:c(OH-)-c(H+)=c(H2CO3)+c(CH3COOH)-c(CO32-),故D错误;
故选B.
点评 本题考查了离子浓度大小比较、盐的水解原理的应用,题目难度中等,注意掌握电荷守恒、物料守恒、盐的水解原理的应用,明确判断离子浓度大小常用方法,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 347kJ/mol | B. | 368 kJ/mol | C. | 386 kJ/mol | D. | 414 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液中滴加酚酞溶液显红色:CO32-+H2O?HCO3-+OH- | |
| B. | 烧碱溶液与小苏打溶液混合:OH-+HCO3-=H2O+CO32- | |
| C. | 硫代硫酸钠溶液与稀硫酸混合:3S2O32-+6H+=4S↓+3H2O+2SO2↑ | |
| D. | 氢氧化铁溶于氢碘酸:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:SO42-、Cl-、Mg2+、NH4+ | |
| B. | 含有较多Ag+溶液:SO42-、K+、Na+、OH- | |
| C. | 能使石蕊试纸变红色的溶液:K+、SO32-、NO3-、Na+ | |
| D. | 含有较多的Al3+的溶液:Na+、SO42-、AlO2-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y |
| W | Z |
| A. | 若X、Y、Z、W中只有一种为金属元素,则W一定为铝元素 | |
| B. | 若W的核电荷数是Y的两倍,则W的氧化物可作半导体材料 | |
| C. | 若Z的核电荷数是Y的两倍,则X的氢化物水溶液显酸性 | |
| D. | 若Y、W的简单阴离子都能破坏水的电离,则Z的简单阴离子也一定能破坏水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
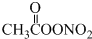 (未配平),下列有关说法正确的是( )
(未配平),下列有关说法正确的是( )| A. | C2H6分子中只存在极性键 | |
| B. | PAN中氧元素化合价均为-2 | |
| C. | 每消耗11.2L O2转移电子的物质的量为2 mol | |
| D. | PAN可水解成硝酸和有机酸,是导致酸雨的原因之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XYZ2 | B. | X2YZ3 | C. | X2YZ2 | D. | XYZ3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com