
| A. |  制取Cl2用 制取Cl2用 | |
| B. |  可完成“喷泉”实验 可完成“喷泉”实验 | |
| C. |  制取干燥的NH3 制取干燥的NH3 | |
| D. |  分离石油,得到汽油、煤油和柴油等各种馏分 分离石油,得到汽油、煤油和柴油等各种馏分 |
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水溶液为紫色 | B. | CCl4层呈橙色 | C. | CCl4层呈紫红色 | D. | 水溶液为橙色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在此反应中,O2氧化剂,PtF6是还原剂 | |
| B. | O2(PtF6)中氧元素的化合价为+1价 | |
| C. | 在此反应中,每生成1 mol O2(PtF6) 则转移1 mol电子 | |
| D. | 在O2(PtF6)中不存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
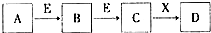 中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )| A. | 若D为NaCl,且A可与C反应生成B,则E可能是CO2 | |
| B. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| C. | 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C | |
| D. | 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- | |
| B. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- | |
| C. | 加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3- | |
| D. | 在AlCl3溶液中:K+、Na+、HCO${\;}_{3}^{-}$、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
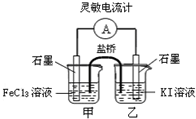
| A. | 反应开始时,乙中电极反应为2I-+2e-═I2 | |
| B. | 反应开始时,甲中石墨电极上发生氧化反应 | |
| C. | 电流表指针为零时,两池溶液颜色相同 | |
| D. | 平衡时甲中溶入FeCl2固体后,乙池的石墨电极为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com